微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中进行反应X2(g)+3Y2(g)  ?2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为(? )
?2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为(? )
A. X2为0.2 mol/L
B. Y2为0.2 mol/L
C. Z2为0.4 mol/L
D. Y2为0.6 mol/L
2、选择题 在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下
(已知相同条件下:2SO2+O2 2SO3?△H =-196.6kJ/mol)。
2SO3?△H =-196.6kJ/mol)。
容器
| 甲
| 乙
| 丙
| 丁
|
起始投入量
| 2m olSO2+1molO2 olSO2+1molO2
| 1molSO2+0.5molO2
| 2molSO3
| 2molSO2+2molO2
|
反应放出或
吸收的热量(kJ)
| a
| b
| c
| d
|
平衡时c(SO3)(mol/L)
| e
| f
| g
| h
|
下列关系正确的是
A.? a=c;e="g?" B.? a>2b;e>2f? C.? a>d;e>h? D.? c+98.3e=196.6
3、选择题 在一定温度下,对于可逆反应C(s)+H2O(g) 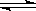 CO(g)+H2(g),其平衡常数表达式正确的是(?)
CO(g)+H2(g),其平衡常数表达式正确的是(?)
A.K=[c(C)·c(H2O)]/ [c(CO)·c(H2)]? B.K= [c(CO)·c(H2)]/ [c(C)·c(H2O)]
C.K=[c(H2O)]/ [c(CO)·c(H2)]?D.K=[c(CO)·c(H2)/ [c(H2O)]]
4、填空题 (16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)?△H=-49.0kJ/mol
CH3OH(g)+H2O(g)?△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 ?
?
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为?。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升 高温度? B.充入He(g),使体系压强增大
高温度? B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离? D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的 同时不断充入氢气,使H2的浓度保持不变,则平衡?;
同时不断充入氢气,使H2的浓度保持不变,则平衡?;
A.向正反应方向移动? B.向逆反应方向移动
C.不移动? D.无法判断
作出此判断的理由是??。
5、填空题 在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t/℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0[
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?。
(2)该反应为?反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是?。
a.容器中压强不变? b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O)? d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为?℃。