微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,KNO3在水中的饱和溶液物质的量浓度是6mol·L-1,若将1mol固体KNO3置于1L水中,则KNO3变成盐溶液过程的△H-T△S的取值为
A.<0
B.=0
C.>0
D.不能确定
参考答案:A
本题解析:因为1mol固体KNO3置于1L水中,没有达到饱和溶液,是自发进行的过程,所以△G=△H-T△S<0时才是自发过程。
考点:考察利用公式计算判断自发反应过程。
点评:正确理解焓判据和熵判据。
本题难度:一般
2、选择题 已知:
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1) △H1
H2O(1)=H2O(g) △H2
C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) △H3
则
参考答案:
本题解析:
本题难度:一般
3、实验题 100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
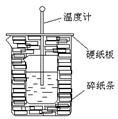
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是 。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案) KJ/mol。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)不相等;相等;
(4)偏小(5) -58.2
本题解析:考查中和热的测定。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)实验过程中需要尽可能的减少热量损失,所以碎纸条的作用是减少实验过程中的热量损失。
(3)由于反应中生成的水不同,所以放出的热量不同。但中和热是不变的,因为中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量。
(4)氨水中存在电离平衡,电离吸热,所以测定结果偏小。
(5)根据题意反应中放出的热量是4.03×6.7×200×1.02+6.7×46.1=5817.074J=5.82kJ
所以反应热是-5.82kJ÷0.1mol=-58.2kJ/mol。
本题难度:一般
4、选择题 通过复习 总结,你认为下列对化学知识概括合理的是
A.金属离子只有氧化性,非金属离子只有还原性
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子品体、金属晶体、分子晶体中都一定存在化学键
D.在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (11分)已知短周期元素X、W、Z、Y核电荷数依次增大。X为原子半径最小的元素,W的最外层电子数是次外层的二倍,Y的最外层电子数为电子层数的三倍。
(1)写出Z单质的电子式_______________________
(2)由X、W、Z三种元素可组成火箭燃料甲,三种元素质量比为2∶6∶7,甲蒸气密度是同温同压下氢气密度的30倍,甲分子式________。Z、Y可形成多种化合物,其中化合物乙Z2Y4可做为火箭燃料燃烧时的供氧剂。虽然化合物甲与乙都有毒,但燃烧产物却无毒。写出化合物甲与乙反应的化学方程式:?________________________
该反应生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(3)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
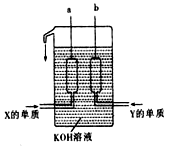
①b是电池的_____________极,a电极上的电极反应式是_________________________,消耗n molY单质时电池内转移的电子个数约为_______________。
②如果燃料电池中,a电极上改为通入X与W两种元素形成?的化合物丙(其它条件不变)写出b电极上的电极反应式是_________________________________。
③如果只把燃料电池电解质改为掺入了三氧化二釔的ZrO2晶体,它在高温下传导O2-(其它条件不变),电池工作时,固体电解质里的O2-向____________极(填a或b)移动,正极反应式为________________________。
参考答案:(1)?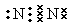 (1分)
(1分)
(2) C2H8N2(1分)。C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑(2分)?小于。(1分)
(3)①正极(1分),2H2+4OH――4e-=4H2O(1分)。4nNA(1分)
②O2+2H2O+4e-=4OH―(1分)?③a (1分)? O2+4e-=2O2-(1分)
本题解析:根据元素的结构及性质可知,X、W、Z、Y分别为H、C、N、O。
(1)氮气中含有三键,电子式为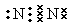 。
。
(2)三种元素的质量之比是2∶6∶7,所以原子个数之比是4∶1∶1。又因为甲蒸气密度是同温同压下氢气密度的30倍,所以甲的相对分子质量是60,则其分子式为C2H8N2。因为燃烧产物无毒,所以产物是氮气、CO2和水,方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。由于是放热反应,所以生成物的总能量小于反应物的总能量。
(3)①原电池中负极失去电子,正极得到电子。所以氢气在负极通入,正极在正极通入。所以b是正极,a是负极,电极反应式为2H2+4OH――4e-=4H2O。1mol氧气在反应中得到4mol电子,所以反应式中转移的电子的数量为4nNA。
②b电极通入的是氧气,反应式为O2+2H2O+4e-=4OH―。
③原电池中电子经导线传递到正极,所以阳离子向正极移动,阴离子向负极移动。正极氧气得到电子,反应式为O2+4e-=2O2-。
本题难度:一般