微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分) 关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为 。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________ 。
(3)已知反应CH3—CH3(g)
参考答案:
本题解析:
本题难度:一般
2、填空题 (14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。

则0~2 min内的平均反应速率υ(C)= 。
参考答案:(1) <;= (2)增大 减小 (3)变深 变浅 (4) 0.1mol·L-1·min-1
本题解析:(1)达到平衡后,当升高温度时,A的转化率变小;说明温度升高平衡向逆反应方向移动,则正反应放热,逆反应为吸热反应,当减小压强时,混合体系中C的质量分数不变,说明压强减小平衡不移动,则方程式中反应物的气体的计量数之和等于生成物气体的化学计量数之和,故答案为:<、=;
(2)若加入B(假设容器的体积不变)平衡向正反应方向移动A的转化率增大,B的转化率减小。故答案为:增大、减小
(3)加入C时平衡左移颜色加深,维持压强不变,充入氦气容器体积膨胀,气体浓度减小颜色变浅。故答案为:加深、变浅
(4)由图可知反应中A增加了0.1 mol,根据方程式A(g)+ B(g) 2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
考点:化学反应平衡的移动、化学反应速率的计算。
本题难度:一般
3、选择题 随着科技的进步,研究和制备物质的手段和途径越来越多,C60、H3、O2+、N5+等已被发现。下列有关说法正确的是
A.H2和H3属于同位素
B.O2+中不含化学键
C.C60中含有共价键
D.N5+中含有离子键
参考答案:C
本题解析:A同位素是质子数相同、中子数不同的同一元素的不同种原子。而同素异形体是同种元素组成的不同性质的单质,H2和H3是同素来源:91考试网 91ExaM.org异形体。错误B在O2+中含共价键,错误。C多原子组成的N5+中含有离子键都以共价键结合,正确。D N5+中N-N原子间含有共价键,错误。
本题难度:一般
4、填空题 (6分)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)写出有关反应的化学方程式 。
(2)实验中观察到的现象有 、 和反应混合物成糊状
(3)通过 现象,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”或“大于”)生成物的总能量
参考答案:(1)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O (1分)
(2)玻璃片上结冰而与小烧杯粘在一起(1分),有少许刺激性气味(1分)
(3)结冰(1分),吸热(1分),小于(1分)
本题解析:(1)强碱和铵盐反应可产生氨气,反应式为Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O。
(2)由于玻璃片上结冰而与小烧杯粘在一起,这说明反应是吸热反应,因此反应物的总能量小于生成物的总能量。
本题难度:一般
5、填空题 (14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
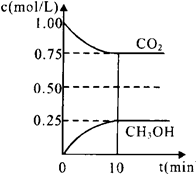
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使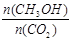 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
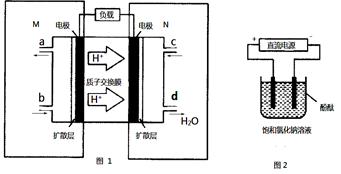
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
参考答案:(1)①AB ②CD ③0.20或 C (2)①CH3OH-6e-+H2O=CO2+6H+
C (2)①CH3OH-6e-+H2O=CO2+6H+
②2Cl-+2H2O H2↑+Cl2↑+2 OH- 0.16g
H2↑+Cl2↑+2 OH- 0.16g
CH3OH(l) + O2(g) =CO2(g) +2H2O(l) ΔH=-(
O2(g) =CO2(g) +2H2O(l) ΔH=-( c+2d-a-b)kJ·mol-1
c+2d-a-b)kJ·mol-1
本题解析:
试题解析:(1)①未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;②升高温度,平衡逆向移动,故比值减小,故A错误;恒温恒容下充入He(g),平衡不移动,故比值不变,故B错误;将H2O(g)从体系中分离,平衡正向移动,故比值变大,故C正确;恒温恒容再充入2mol CO2和3mol H2,相当于增大压强,平衡正向移动,故比值变大,故D正确;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以: K=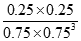 =0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O
=0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O
H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O H2↑+Cl2↑+2OH-可知:
H2↑+Cl2↑+2OH-可知:
CH3OH ~ 6e- ~ 6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g;
(3)应用盖斯定律解题,△H=-△H1-△H2+ △H3+2△H4=-(
△H3+2△H4=-( c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
c+2d-a-b)kJ?mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-(
O2(g)=CO2(g)+2H2O(l)△H=-( c+2d-a-b)kJ?mol-1。
c+2d-a-b)kJ?mol-1。
考点:化学反应中的能量变化、化学平衡、电化学
本题难度:一般