微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是
A.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 ="2" FeO42-+3Cl-+H2O+4H+
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.向NaAlO2溶液中通入过量CO2 2AlO2-+CO2+3H2O = 2Al(OH)3↓+ CO32--
D.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-=BaSO4↓+H2O
参考答案:B
本题解析:A错,强碱性溶液中不可能生成氢离子;B正确;C错,正确为:AlO2-+CO2+2H2O = Al(OH)3↓+ HCO3--;D错,正确为:H++2SO42-+2Ba2+十OH-=2BaSO4↓+H2O;
本题难度:一般
2、选择题 在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的离子浓度为0.2mol/L,当加入等体积0.2mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+离子的浓度最接近于( )
A.0.125mol?L-1
B.0.225mol?L-1
C.0.250mol?L-1
D.0.450mol?L-1
参考答案:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积0.2mol/L KOH溶液时,生成的沉淀恰好完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=14n(OH-),所以原溶液中c(Al3+)=14c(OH-)=14×0.2mol/L=0.05mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,混合后的体积为原来的2倍,钾离子来源于原混合溶液及氢氧化钾溶液,反应后溶液中K+离子的浓度为12×(0.25mol/L+0.2mol/L)=0.225mol/L.
故选:B.
本题解析:
本题难度:简单
3、选择题 下列各组离子在强酸性溶液中能大量共存的是
A.Ba2+ Na+ SCN--- Fe3+
B.Mg+ Cl- Al3+ SO42-
C.K+ Cl- HCO3- NO3-
NO3-
D.Ca2+ Na+ Fe3+ AlO2-
参考答案:B
本题解析:略
本题难度:一般
4、选择题 能正确表示下列反应的离子方程式的为( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+ Fe2++H2S↑
Fe2++H2S↑
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O Al
Al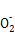 +4N
+4N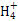 +2H2O
+2H2O
C.硫代硫酸钠溶液中滴入稀盐酸:S2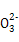 +2H+
+2H+ S↓+SO2↑+H2O
S↓+SO2↑+H2O
D.在NaHSO4溶液中滴加Ba(OH)2至中性:H++S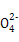 +Ba2++OH-
+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O
参考答案:C
本题解析:Fe2+和H2S具有还原性,稀HNO3具有氧化性,不能生成Fe2+和H2S,A项错误;Al(OH)3不溶于NH3·H2O,其离子反应方程式为:Al3++3NH3·H2O Al(OH)3↓+3N
Al(OH)3↓+3N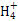 ,B项错误;NaHSO4与Ba(OH)2反应呈中性的离子反应方程式为2H++S
,B项错误;NaHSO4与Ba(OH)2反应呈中性的离子反应方程式为2H++S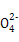 +Ba2++2OH-
+Ba2++2OH- BaSO4↓+2H2O,D项
BaSO4↓+2H2O,D项
错误。
本题难度:一般
5、简答题 .某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钠中的一种或几种组成.某学生已经设计好实验方案鉴别.
| 实验操作 | 实验现象 | 结论
①取部分粉末,加水溶解.将所得溶液分成三份,分别进行实验②③④
得无色溶液
②滴加稀硫酸
无明显现象
③滴加氢氧化钠溶液
出现白色沉淀
④加入足量AgNO3溶液
含有NaCl
|
写出③和④中反应的离子方程式:③______;④______.
参考答案:由①中得到无色溶液,则一定不存在硫酸铜,由②加酸无现象,则一定不存在碳酸钠,由③滴加氢氧化钠溶液,出现白色沉淀,则一定含硝酸镁,由④中含NaCl,则与硝酸银反应生成白色沉淀,③中发生Mg2++2OH-=Mg(OH)2↓,④中发生Ag++Cl-=AgCl↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Ag++Cl-=AgCl↓.
本题解析:
本题难度:一般