微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气
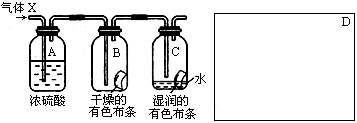
回答下列问题:
(1)该项研究(实验)的主要目的是?。
(2)浓H2SO4的作用是?,与研究目的直接相关的实验现象是?。
(3)该实验装置设计上存在的缺陷为?,请在上图的D处画出能克服该缺陷的装置。
参考答案:(1)比较干燥C12与湿润C12谁有漂白性;
(2)吸收气体X中的水;? B中的布条不褪色,C中的布条褪色;
(3)Cl2会污染空气;如图: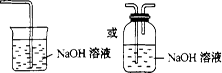 (其他装置合理也可)
(其他装置合理也可)
本题解析:该实验是气体X通过浓硫酸干燥氯气,干燥的氯气通入B,不能使干燥的有色布条褪色。再通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性。氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,同时考虑氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O。
(1)本实验为对比实验,将氯气分别通入干燥布条和湿润布条,根据实验现象的不同来探究氯气具有漂白性的条件。因此该项研究(实验)的主要目的是比较干燥C12与湿润C12谁有漂白性。
(2)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体X中的水的作用。与研究目的直接相关的实验现象是B中的布条不褪色,C中的布条褪色。
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,所以该实验装置设计上存在的缺陷为Cl2会污染空气,改进的方法是加上尾气处理装置。
点评:该题以氯气的性质实验探究为载体,侧重对学生实验能力的考查,涉及气体的净化、除杂、性质检验、尾气处理以及实验分析与评价,有利于培养学生规范、严谨的实验设计能力,有利于提升学生的学科素养。
本题难度:一般
2、选择题 饱和氯水长时间放置后,下列微粒在溶液中的物质的量增加的是
A.Cl—
B.HClO
C.Cl2
D.ClO—
参考答案:A
本题解析:Cl2+H2O  ?HCl+HClO,HClO见光分解,导致平衡右移,且HClO
?HCl+HClO,HClO见光分解,导致平衡右移,且HClO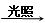 HCl,所以Cl—浓度增大。
HCl,所以Cl—浓度增大。
本题难度:一般
3、填空题 (10分)A是一种强酸,其浓度超过40%时就会迅速分解,产生比它的酸性更强的酸B,同时放出气体C和D,该气体经干燥后,平均分子量为47.6,所得气体通过80℃NaOH溶液,得到的产物中一种是A的钠盐,同时还剩余一种可以使带火星的木条复燃的气体D。试完成下列各题:
(1)确定各物质的化学式A________、B________、C________、D____________;
(2)气体C和D的体积比__________ _____;
_____;
(3)写出A分解方程式并配平;?;
(4)写出气体C与湿润的淀粉-碘化钾试纸的反应方程式_____________________;
(5)写出将气体C通过80℃NaOH溶液时发生的反应方程式___________________。
参考答案:1.A:HClO3? B:HClO4? C:Cl2? D:O2(各1分)
2.气体组成为O2︰Cl2=3︰2(2分)
3.8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O(2分)
4.2KI+Cl2=2KCl+I2?
5.3Cl2+6NaOH=5NaCl+NaClO3+3H2O(2分)
本题解析:略
本题难度:一般
4、选择题 (CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe + 3(SCN)2 ="==" 2Fe(SCN)3,2Fe + 3Cl2 ="==" 2FeCl3。以此判断下列化学方程式中错误的是?
A.(CN)2 + H2O HCN + HCNO
HCN + HCNO
B.(SCN)2 + 2Cu  2CuSCN
2CuSCN
C.(OCN)2 + 2NaOH ="==" NaOCN + NaOCNO + H2O
D.MnO2 + 4HSCN(浓) (SCN)2? + Mn(SCN)2 + 2H2O
(SCN)2? + Mn(SCN)2 + 2H2O
参考答案:B
本题解析:A正确,为岐化反应;B错,正确为(SCN)2 + Cu  ?Cu(SCN)2;C正确,为岐化反应;D正确,氧化还原反应;
?Cu(SCN)2;C正确,为岐化反应;D正确,氧化还原反应;
本题难度:一般
5、选择题 下列各步反应A(HCl)→B(Cl2)→C(NaClO)→D(HClO)→E(CO2),其中不能一步直接实现的是
A.A→B
B.B→C
C.C→D
D.D→E
参考答案:D
本题解析:浓盐酸与二氧化锰在加热条件下可以生成氯气,A项可以;氯气与氢氧化钠反应生成次氯酸钠,B项可以;次氯酸钠与盐酸或碳酸生成次氯酸,C项可以;次氯酸是比碳酸还弱的酸,不能生成二氧化碳,D项错误。
点评:氯气及其化合物的性质及转化要熟练掌握,形成系统性。属于简单题。
本题难度:简单