| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《金属的腐蚀与防护》高频试题预测(2017年最新版)(二)
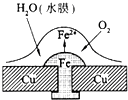 参考答案:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀. 本题解析: 本题难度:一般 5、填空题 蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O |
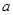 g M,则金属M的相对原子质量为?(用含“
g M,则金属M的相对原子质量为?(用含“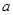 、x”的表达式表示)。
、x”的表达式表示)。参考答案:(1)A?(2)①50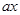 ?②0.168;? 2
?②0.168;? 2
本题解析:分析蓄电池的反应可知发生还原反应的物质是NiO2,(2)Mx++xe-=M,当增加agM时其相对原子质量为50ax;电解混合溶液时阳极2Cl- -2e-=Cl2↑0.01molCl-失去0.01mole-,而电路中转移0.02mole-,所以溶液中的OH-放电,4OH- -4e-=2H2O+O2↑且失去0.01mole-,生成0.0025mol氧气,所以阳极生成气体的总量为0.0075mol,体积为0.168L.同时溶液中消耗0.01molOH-,H+的物质的量为0.01mol,1L溶液中的c(H+)=0.01mol/L.pH=2.
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《常见的化学.. | |