微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA
B.用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA
C.25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA
D.100 mL 12 mol·L-l浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA
参考答案:A
本题解析:常温下,30 L pH=11的Na2CO3溶液中含有的OH-的物质的量为10-3×30L=0.03mol,所以OH-的个数为0.03NA,A选项正确;胶体粒子是氢氧化铁形成的集合体,微粒数一定小于0.1NA,故B错误;25℃时,pH=13的1LBa(OH)2溶液中含有的OH-的物质的量为10-1×1L=0.1mol,所以OH-的个数为0.1NA,C选项错误;依据化学方程式 MnO2+4HCl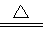 MnCl2+Cl2↑+H2O,100 mL×12 mol·L-l当1.2molHCl完全反应时可生成0.3NACl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.3NA,D选项错误。
MnCl2+Cl2↑+H2O,100 mL×12 mol·L-l当1.2molHCl完全反应时可生成0.3NACl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.3NA,D选项错误。
本题难度:一般
2、选择题 NA为阿伏加德罗常数的数值,下列说法中正确的是(?)
A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA
D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
参考答案:B
本题解析:A、因合成氨的反应为可逆反应,不能进行到底,错误;B、2.3g钠(0.1mol)不论生成氧化钠还是过氧化钠,都生成+1价的Na+,都会失去0.1mol电子,正确;C、因S2-离子会水解,使其数目小于0.1NA,错误;D、标准状况下CCl4是液态,不能应用标准状况的气体摩尔体积计算,错误。
本题难度:一般
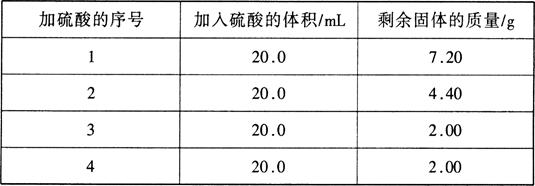
3、选择题 现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
试计算:
(1)此样品中铁的质量分数为?
(2)所用硫酸溶液的物质的量浓度为?
参考答案:(1)80%?(2)? 2.5mol/L
本题解析:Fe与硫酸反应,Cu不与硫酸反应,由题意可知,在序号3、4中,剩余固体质量不变,说明Fe反应完全,剩余的固体为Cu,所以Cu的质量为2.00g,因此Fe的质量为10.0-2.0=0.8g,质量分数为80%。在序号1中,硫酸完全反应,消耗20ml,消耗的Fe的质量为2.8g,物质的量为0.05mol,由Fe与硫酸反应的方程式,可知参与反应的硫酸的物质的量为0.05mol,因此硫酸的浓度为0.2/0.05=2.5mol/L。
本题难度:一般
4、选择题 下列说法中不能成立的是(?)
A.1 mol某种物质的质量称为该物质的摩尔质量
B.1 mol某种物质的体积称为该物质的摩尔体积
C.固体和液体的摩尔体积各不相同
D.气体摩尔体积都约为22.4 L/ mol
参考答案:D
本题解析:A成立,摩尔质量的定义为单位物质的量的物质所具有质量;B成立,摩尔体积的定义为单位物质的量的物质所占有的体积;C成立,固体和液体的摩尔体积各不相同;D不成立,缺少了标准状况;
本题难度:简单
5、选择题 已知硫酸的密度随浓度的增加而增大,98%的 浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸溶液的物质的量浓度为
浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸溶液的物质的量浓度为
A.等于9.2mol/L
B.大于9.2mol/L
C.小于9.2mol/L
D.不能确定
参考答案:C
本题解析:略
本题难度:一般