微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用勒沙特列原理解释的是( )
A.合成氨反应:N2(g)+3H2(g)

2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施
B.对2HI(g)

H2(g)+I2(g)平衡体系增加压强使颜色变深
C.使用催化剂有利于提高SO2与O2生成SO3的效率
D.用排饱和氯化钠溶液的方法来收集氯气
参考答案:A.对N2(g)+3H2(g)

2NH3(g);△H<0,正反应为气体总物质的量减小的反应,且正反应为放热反应,为使氨的产率提高,就要使化学平衡向正反应方向移动,就要降温并且加压,A与勒夏特列原理符合,故A错误;
B.对2HI(g)

H2(g)+I2(g)反应前后气体的总物质的量相等,增大压强,平衡不移动,气体颜色变深是因为体积减小,I2的物质的量浓度增大,不能用勒夏特列原理解释,故B正确;
C.催化剂只能同等程度地改变正逆反应速率,对化学平衡无影响,即不能用勒夏特列原理解释,故C正确;
D.排饱和氯化钠溶液的方法来收集氯气,相当于对Cl2+H2O?H++Cl-+HClO加入NaCl,增大了Cl-的难度,使平衡向逆反应方向移动,降低了氯气的溶解度,即可用勒夏特列原理解释,故D错误;
故选BC.
本题解析:
本题难度:简单
2、填空题 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图
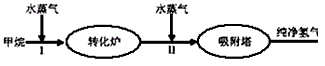
(1)此流程的第II步反应为:CO(g)+H2O(g)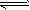 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________;反应的平衡常数随温度的变化如表一
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________;反应的平衡常数随温度的变化如表一
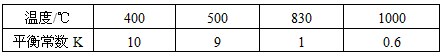
从上表可以推断:此反应是________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mo1,则达到平衡后 CO的转化率为___________。
(2)此流程的第II步反应CO(g)+H2O(g)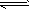 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)
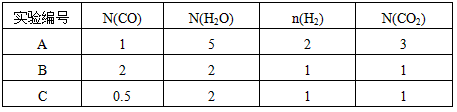
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是_________
① 体系的压强不再发生变化
② 混合气体的密度不变
③ 混合气体的平均相对分子质量不变
④ 各组分的物质的量浓度不再改变
⑤ 体系的温度不再发生变化
⑥ v(CO2正)=v(H2O逆)
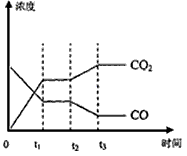
(4)图表示该反应此流程的第II步反应在时刻t 达到平衡、在时刻t分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为___________________。
参考答案:(1)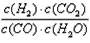 ;放;50%?
;放;50%?
(2)B
(3)④⑤⑥
(4)降低温度或增加水蒸汽的量或减少氢气的量
(5)CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ·mol-1
本题解析:
本题难度:困难
3、选择题 某温度下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均增加1mol
D.均减少1mol
参考答案:A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.
本题解析:
本题难度:简单
4、选择题 下图所示的是表示外界条件(温度、压强)的变化对下式反应的影响:L(s)+G(g) 2R(g)(正反应为吸热反应),在下图中,y轴是指
2R(g)(正反应为吸热反应),在下图中,y轴是指
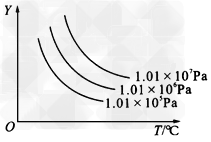
[? ]
A.平衡时混合气体中G的百分含量 ?
B.平衡时混合气体中R的百分含量?
C.G的转化率 ?
D.L的转化率
参考答案:A
本题解析:
本题难度:一般
5、填空题 在一小烧杯里混合10ml0.01mol/LFeCl3溶液和10ml0.01mol/LKSCN溶液,溶液立即变为红色.
(1)再向溶液中滴入1mol/LFeCl3溶液,现象______,平衡向______反应方向移动,KSCN浓度会______.
(2)在烧杯中加入KCl固体,颜色______,平衡______移动.
参考答案:(1)发生反应FeCl3+3KSCN?Fe(SCN)3+3KCl反应,存在平衡:Fe3++3SCN-=Fe(SCN)3,滴入1mol/LFeC13溶液,铁离子浓度增大,平衡正向进行溶液颜色加深,平衡移动后KSCN浓度会减小,
故答案为:溶液红色加深,正;降低;
(3)平衡为Fe3++3SCN-=Fe(SCN)3,加入KC1固体,对存在平衡的离子浓度不影响,平衡不动,溶液颜色不变;
故答案为:无变化,不.
本题解析:
本题难度:一般