微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.
①在试管Ⅰ里加入的试剂是______.
②在试管Ⅱ里加入的试剂是______.
③为了制得Fe(OH)2白色沉淀,正确的操作顺序是______(填下列序号)
A.打开止水夹?B.检验试管Ⅱ出口处排出的H2的纯度
C.夹紧止水夹?D.在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子
④写出此过程中涉及到的化学方程式______.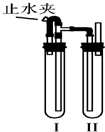
参考答案:①铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,所以在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,故答案为:稀H2SO4、铁屑;
②试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,并能产生氢气,当氢气使装置Ι中压强变大,使Ι中的药品硫酸亚铁进入Ⅱ中,与Ⅱ中的药品氢氧化钠反应得到氢氧化亚铁,故答案为:NaOH溶液;
③此题涉及气体生成与检验,所以要检查装置的气密性,检查完毕在装置中加入试剂并塞上塞子,打开止水夹,Ⅰ中生成氢气进入装置Ⅱ,要检验装置Ⅱ中空气是否排尽,要在装置Ⅱ导管口检验气体的纯度,待气体纯净,关闭止水夹,Ⅰ中气压增大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,故答案为:DABC;
④由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;氢氧化钠与硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,硫酸与氢氧化亚铁反应生成硫酸亚铁和水,故答案为:FeSO4+2NaOH═Fe(OH)2↓+Na2SO4(必写),H2SO4+2NaOH═Na2SO4+2H2O(或H2SO4+Fe(OH)2═FeSO4+2H2O).
本题解析:
本题难度:一般
2、简答题 (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:?
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为?。在实验室中,FeCl2可用铁粉和?盐酸反应制备,FeCl3可用铁粉和?反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为?
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为?
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为?,该电池总反应的离子方程式为?。
参考答案:(1)3 (2)10% (0.10也可以) 盐酸?氯气
(3)2Fe3++2I-=2Fe2++I2或2Fe3++3I-=2Fe2++I3-

本题解析:

(4)根据题意,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,根据元素守恒、电子转移守恒,可得反应的离子方程式。根据原电池反应原理,锌做负极材料,失电子,发生氧化反应;K2FeO4在电池中作为正极材料,得电子,发生还原反应。
【考点定位】铁及其化合物、酸碱中和滴定、离子方程式的书写、电化学、化学计算。
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A.钠钾合金可用作原子反应堆的导热剂是因为钠、钾金属很活泼
B.做锅热反应实验时,镁条的作用是还原剂
C.铜的氧化物有CuO和Cu2O,其中Cu2O不稳定,在空气中加热易转变为CuO
D.氧化铁或氢氧化铁中的铁元素为+3价,故在氧化还原反应中只作氧化剂
参考答案:C
本题解析:
本题难度:简单
4、填空题 由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O

(1)①中产生气体的电子式是?。
(2)用离子方程式表示过程②中稀硝酸的作用?,在该过程中要不断向溶液中补充盐酸,目的是?。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3?
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因?。
(4)过程ⅱ中产生FeCl2的化学方程式是?。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
品 名
| 氯化亚铁
|
理化特性
| 白色,遇空气易变成黄色,易吸水,有腐蚀性……
|
注意事项
| 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热
|
?
(5)下列说法正确的是?。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是?。
参考答案:(1)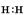 (1分)
(1分)
(2)3Fe2+ + NO3- + 4H+ ="3" Fe3+ + NO↑+ 2H2O (2分)
补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质(2分)
(3) 6SOCl2 + FeCl3?6H2O = FeCl3 + 12HCl↑+ 6SO2↑,生成的HCl会抑制FeCl3的水解,得到无水FeCl3(2分)
(4)2FeCl3 + H2?△ ?2FeCl2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl2 + H2O + O2?△ ?2FeCl3 + Fe2O3+ 2HCl(2分)
本题解析:铁和盐酸反应生成FeCl2和氢气,加入硝酸氧化为FeCl3,还有盐酸抑制Fe3+的水解,补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质,最后结晶获得晶体。
本题难度:困难
5、填空题 铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下:
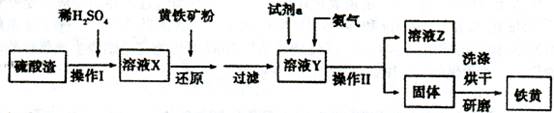
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_?、?
(2)试剂a最好选用_?(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_?。
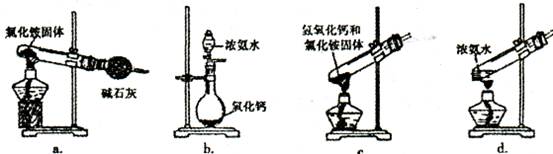
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_?_(填序号)。
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4?、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。
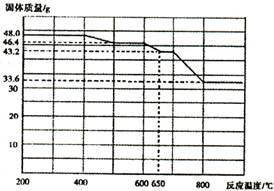
?
参考答案:
(1)搅拌加速溶液;引流。(2)空气;作氧化剂,将二价铁离子氧化为三价铁离子;(3)bd; (4)
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
本题解析:(1)操作I是搅拌加速溶液溶解,操作II是过滤操作,主要用到玻璃棒引流。(2)试剂a最好选用空气,来源廉价,其作用是作氧化剂,将二价铁离子氧化为三价铁离子。(3)实验室制氨气的主要是操作简单,制作方便,由于氨气易溶于水,故要加热,可选择bd。(4)对于二价铁离子有无可用KSCN溶液不显红色判断,对于有无固体铁可用加入酸有无气泡做出判断。CO还原氧化铁的还原产物为可能Fe3O4,FeO和Fe,Fe2O3加热温度可达到500℃~600℃,质量由46.4g减少为45g,还原产物为Fe3O4;650℃~700℃时,质量由43.2g减少较大,还原产物为FeO,为验证还原产物,在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去,可说明还原产物为FeO,故答案为:Fe3O4;在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去。
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
考点:
本题难度:困难