微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某反应物A浓度是1.0mol/L,2s后A的浓度变为0.8mol/L,在这2s内A的化学反应速率是( )
A.0.1mol/(L?s)
B.0.2mol/(L?s)
C.0.3mol/(L?s)
D.0.4mol/(L?s)
参考答案:2s内从1.0mol/L变为0.8mol/L,则△c=0.2mol/L,
v=△c△t=0.2mol/L2s=0.1 mol/(L?s),
故选A.
本题解析:
本题难度:一般
2、填空题 用图中所示实验装置证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用图示装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:
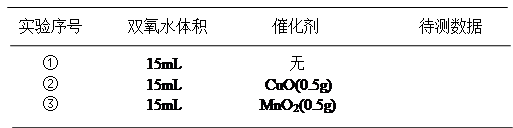
(1)从实验原理来看,实验中的“待测数据”可以指、也可以指?。
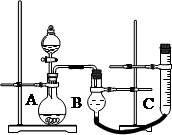
(2)实验时气体收集在B中,B仪器名称是__________。若要检验产生的气体是O2,待气体收集结束?后,用弹簧夹夹住B下端乳胶管,打开单孔橡皮塞,?。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验不必写具体步骤):a.证明CuO的化学性质没有变化,b.?。
(4)为证明氧化铜的化学性质在加入双氧水前后没有发生改变,你设计验证的实验是?。
(5)实验开始时,当往容器中加入一定量的双氧水后,由于短时间内产生大量气体,分液漏斗内的液体不能顺利流下,为了解决这个问题,你采取的措施是?;在测量生成的气体体积时,除了要注意视线与凹液面相平以外,还应注意?
参考答案:(1)时间和气体体积或相同时间内放出气体所占的体积(或一定时间内右侧水面上升的高度);也可以指产生相同体积气体所需要的时间
(2)干燥管;把带火星的木条插入干燥管,看是否复燃
(3)证明CuO的质量在反应前后没有变化
(4)分别取加入双氧水前后的氧化铜,进行与H2(或CO、C等还原剂)的反应或与酸溶液的反应的性质实验比较
(5)使塞子上的凹槽对准瓶壁上小孔;左右两端液面相平;反应前后容器温度相同
本题解析:(1)根据题意知,该实验的目的是比较反应速率,所以实验中的“待测数据”可以指时间和气体体积或相同时间内放出气体所占的体积(或一定时间内右侧水面上升的高度);也可以指产生相同体积气体所需要的时间。(2)根据仪器的构造特点可知,B仪器名称是干燥管。氧气是助燃性气体,所以检验氧气的实验方法是把带火星的木条插入干燥管,看是否复燃。(3)判断一种物质是催化剂,除能改变反应速度外,还要验证:一是质量不变,二是其化学性质不变,即证明CuO的质量在反应前后没有变化。(4)根据氧化铜的化学性质可知,要证明氧化铜的化学性质在加入双氧水前后没有发生改变,设计验证的实验可以是分别取加入双氧水前后的氧化铜,进行与H2(或CO、C等还原剂)的反应或与酸溶液的反应的性质实验比较。(5)要使液体顺利滴下则应该是内外压强相同,所以采取的措施是使塞子上的凹槽对准瓶壁上小孔;在测量气体体积时,应该是两侧的压强相同,且温度也是相同,所以措施是使左右两端液面相平,且反应前后容器温度相同。
本题难度:一般
3、选择题 在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是
A.vA=1mol·L-1·min-1
B.vB=1mol·L-1·min-1
C.vC=2mol·L-1·min-1
D.vB=2mol·L-1·min-1
参考答案:B
本题解析:略
本题难度:简单
4、填空题 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
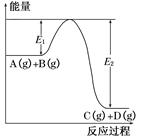
(1)该反应是________(填“吸热”或“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是________________________________________
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是__________________________________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________。(填“增大”“减小”或“不变”)
参考答案:(1)放热
(2)减小 根据勒·夏特列原理,升高温度有利于反应向吸热反应方向移动,因而该反应中A的转化率减小
(3)没有 催化剂只能改变化学反应的速率和途径,不能改变化学反应的始态和终态的能量,因此对反应热没有影响
(4)减小 减小
本题解析:解答第(1)题的关键是读懂图,由图示可知反应物A(g)+B(g)所含的能量大于生成物C(g)+D(g)所含的能量,故该反应为放热反应。解答第(2)题结合第(1)题的推断可知,升高温度平衡向逆反应方向(吸热反应方向)移动,故升高温度,A的转化率减小。第(3)、(4)题,加入催化剂只能改变反应途径,使E1(活化能)减小,E2同时减小,增大反应速率,不改变化学反应的始态和终态的能量,而反应热只与化学反应的始态和终态有关,与反应途径无关,因此使用催化剂对反应热没有影响。
本题难度:一般
5、计算题 在一定温度和压强下,有如下反应:2SO2(g)+O2 (g) ?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
(1)达平衡时混合气体的体积为___________,SO2的转化率为___________;
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120 L。则a、b的值分别为:a=_________,b=_________;
(3)若容器为体积不变的密闭容器,其容积为100 L。起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为________,x、z应该满足的关系式为_____________。
参考答案:(1)80 L 60%(2)? 2.4? 1.2
(3)x∶y=2∶1x+z=2
本题解析:(1)反应前后,气体总质量不变,则平衡时V(总)=
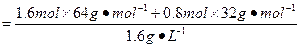 ="80" L。
="80" L。
2SO2(g)? +? O2 (g) 2SO3(g)
2SO3(g)
起始:1.6 mol? 0.8 mol? 0
转化:2x? x? 2x
平衡:1.6-2x? 0.8-x? 2x
因为: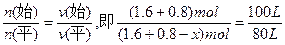 ,故x="0.48" mol,n(平)="1.92" mol。
,故x="0.48" mol,n(平)="1.92" mol。
α(SO2)=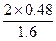 ×100%=60%
×100%=60%
(2)当保持温度、压强不变时,按n(SO2)∶n(O2)=2∶1通入a mol SO2和b mol O2,建立起等效平衡,则α(SO2)不变。因为a=2b,所以n(SO2)=2b。在(1)中n(平)="1.92" mol,在(2)时达到平衡时:
2SO2(g)+O2(g) 2SO3(g)?Δn
2SO3(g)?Δn
2? 1
2b·60%? 0.6b
n2(平)=3b-0.6b=2.4b
又知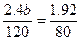 ,所以b=1.2,a=2.4
,所以b=1.2,a=2.4
(3)中x∶y=2∶1,x+z=2。
本题难度:简单