微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
反应进程
(分钟)
| 1
| 2
| 5
| 15
| 20
|
4.0 mol/L
盐酸
| 少量气泡
| 较多气泡
| 大量气泡
| 反应剧烈
| 铝片耗尽
|
2.0 mol/L
硫酸
| 无明显现象
| 极少量
气泡
| 少量气泡
|
4.0 mol/L
硫酸
| 无明显现象
| 少量气泡
| 有比较连续的气泡
|
?
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式:?。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是?。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想:?(写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
实验目的
| 实验
编号
| 温度
/℃
| 金属铝的
形态
| 盐酸浓度
/mol·L-1
|
1.实验①和②探究盐酸浓度对该反应速率的影响;
2.实验①和③探究温度对该反应速率的影响;
3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响
| ①
| 25
| 铝片
| 4.0
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| ?
| ?
|
?
2、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
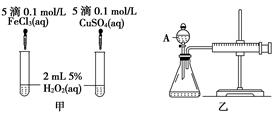
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 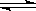 ?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
3、选择题 对于反应:CaCO3+2HCl=CaCl2+ H2O+CO2↑,下列说法正确的是?
?[? ]
A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同
B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示
C.用H2O和CO2表示的化学反应速率相同
D.用CaCl2浓度的减小表示其反应速率
4、选择题 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是(?)
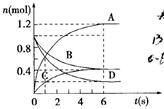
A.该反应的化学方程式为3B+4D=6A+2C
B.反应进行到6s时υ(B)=υ(C)
C.反应进行到6s时,用B表示的平均反应速率为0.05mol·L-1·s-1
D.反应进行到6s时,反应停止了
5、实验题 催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察?,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是______________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是? ?。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①实验时放出气体的总体积是?mL。
②放出1/3气体所需时间为 ??min。
③计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑤?解释④反应速率变化的原因? ___? _____。