微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的 产物,则[Cu(NH3)4]2+的空间构型为_________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为_________________。
参考答案:(1)AB
(2)平面正方形
(3)sp2
本题解析:
本题难度:一般
2、填空题 (1)向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色:FeCl3+3KSCN=Fe(SCN)3+3KCl。向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,发生该现象的可能原因是__________________________
(2)无水CoCl2为深蓝色,吸水后变为粉红色的水化物(CoCl2·XH2O),水化物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。现有65g无水CoCl2吸水后变成119gCoCl2·XH2O。经测定该化合物中Co2+配位数为6,1mol CoCl2·XH2O溶于水后,滴加硝酸银溶液,析出1mol AgCl沉淀。则
CoCl2·XH2O的化学式用配合物的形式可表示为_____________。
参考答案:(1)FeF3比Fe(SCN)2+更难电离(或Fe3+结合F-的能力大于结合SCN-的能力)
(2)[Co(H2O)5Cl]Cl·H2O
本题解析:
本题难度:一般
3、选择题 下列属于配位化合物的是( )
A.NH4Cl
B.Na2CO3?10H2O
C.CuSO4?5H2O
D.CO(NH3)6Cl3
参考答案:CD
本题解析:
本题难度:简单
4、简答题 确定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4
A
578
1817
2745
11578
B
738
1451
7733
10540
|
A通常显______价,A的电负性______B的电负性;
A的第一电离能______B的第一电离能(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | KCl | MgO | CaO
晶格能/kJ?mol-1
715
3791
3401
|
则该?4种离子晶体熔点从高到低的顺序是:______.其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
(4)某配合物的分子结构如图2所示,其分子内不含有______(填序号).
A.离子键?B.极性键?C.金属键
D.配位键?E.氢?键?F.非极性键
(5)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是______,与同一个N3-相连的X+有______个.
(6)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是______
A.SP,范德华力?B.sp2,范德华力?C.sp2,氢键?D.sp3,氢键
(7)CaC2中与互为等电子体,的电子式可表示为______;1mol?中含有的π键数目为______.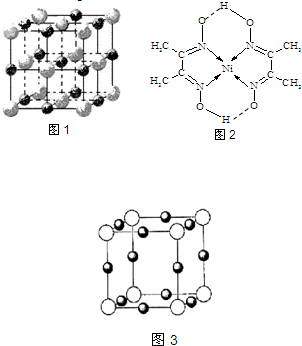
参考答案:(1)从表中原子的第一至第四电离能可以看出,A的第三电离能小,第四电离能较大,说明易失去3个电子,
则A的化合价为+3价,应为Al元素,B的第二电离较小,第三电离能较大,说明易失去2个电子,则B的化合价为+2价,应为Mg元素,镁的电负性小于铝的,而铝的第一电离能小于镁的;
故答案为:+3;>;<;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,氮离子电荷大于镁离子和钙离子,镁、钙离子电荷大于钾离子,镁离子半径小于钙离子半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl,采用X、Y、Z三轴切割的方法知,镁离子周围和它最邻近且等距离的Mg2+有12个,
故答案为:TiN>MgO>CaO>KCl;12;
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,V 5+核外电子排布式为1S22S22P63S23P6,核外没有孤电子,Cr4+核外电子排布式为1S22S22P63S23P63d1,有1个孤电子,所以适合作录音带磁粉原料的是CrO2,故答案为:CrO2;
(4)该配合物中,碳原子和碳原子之间存在非极性共价键,碳原子和氢原子之间存在极性共价键,镍原子和氮原子之间存在配位键,氧原子和另一分子的氢原子间存在氢键,
故选AC;
(5)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子为铜元素,采用X、Y、Z三轴切割的方法知X+个数是6;
故答案为:Cu;6;
(6)在硼酸[B(OH)3]分子中,每个B原子含有3个σ键,不含孤电子对,所以采取sp2杂化,N、O、F与与另一分子的H原子易形成氢键,氢键比范德华力大,所以同层分子间的主要作用力是氢键,故选C;
(7)CaC2中C2-2与O2+2、N2都互为等电子体,由氮气分子的电子式知O2+2的电子式为
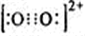
,每个O2+2中含有2个π键,所以1mol?O2+2中含有的π键数目是2NA,
故答案为:
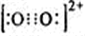
;2NA.
本题解析:
本题难度:一般
5、简答题 阅读以下信息,并回答问题.
数十亿年来,地球上的物质不断地变化.大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分:
| 目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等
原始大气的主要成分
CH4、NH3、CO、CO2等
|
用上表所涉及的分子填写下列空白:
(1)由极性键构成的非极性分子有______和______(填写化学式).
(2)极易溶于水、其水溶液呈碱性的物质的分子是______(填写化学式),它之所以极易溶于水,是因为它的分子和水分子之间可形成______键.
(3)分子中不含孤对电子的分子(除稀有气体外)为______(填写化学式),它的立体构型为______.
(4)CO的结构可表示为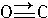 ,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
(5)随着原始大气中O2的缓慢增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成目前空气.原始大气中NH3可转化为目前空气中的______(填化学式).
(6)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合或Cu(I)(I表示化合价为+1)时,分别形成a和b:
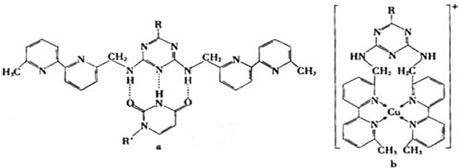
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含______,b中含______.(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
参考答案:(1)甲烷中氮原子和氢原子之间存在极性键,甲烷是正四面体结构,正负电荷重心重合;二氧化碳分子中碳原子和氧原子之间存在极性键,二氧化碳是直线型结构,正负电荷重心重合,所以甲烷和二氧化碳是非极性分子,
故答案为:CH4;CO2;
(2)氨气极易溶于水,是由于氨气能与水分子之间形成氢键,氨气溶于水,与水反应形成一水合氨:NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,
故答案为:NH3;氢;
(3)N2、O2、CO2、水蒸气、NH3、CO的孤对电子分别为2对,4对,4对,2对,1对,2对,CH4中无孤对电子,由于碳原子采取SP3杂化,分子构型为正四面体,
故答案为:CH4;正四面体;
(4)CO与N2是等电子体,等电子体的结构相似,N2是由同种元素组成的双原子分子为非极性分子;CO是由不同种元素组成的双原子分子为极性分子;由CO的结构: 可知分子含有1个配位键,2个共价键,
可知分子含有1个配位键,2个共价键,
故答案为:N2;不相同;配位;
(5)目前空气的主要成分N2、O2、CO2、水蒸气,由元素守恒可知原始大气中的NH3转化为现代大气中的N2和H2O,反应方程式为:4NH3+3O2=2N2+6H2O,
故答案为:N2和H2O;
(6)a中碳原子和碳原子之间存在非极性键,碳原子和氮原子之间、氮原子和氢原子之间、碳原子和氢原子之间都存在极性键,氮原子和氢原子之间存在氢键;b中碳原子和碳原子之间存在非极性键,碳原子和氮原子之间、氮原子和氢原子之间、碳原子和氢原子之间都存在极性键,铜原子和氮原子间存在配位键,所以a和b中微粒间的相互作用的不同点:a中含氢键,b中含配位键,
故答案为:氢键;配位键.
本题解析:
本题难度:简单