微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于复合材料的说法不正确的是
[? ]
A、金属材料不能制成复合材料
B、玻璃钢是日常生活中常用的复合材料,其强度可超过合金钢
C、跳高运动员用的撑杆为复合材料制作
D、复合材料具有不可估量的应用前景,人类已从合成材料时代进入复合材料时代
参考答案:A
本题解析:
本题难度:简单
2、填空题 电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
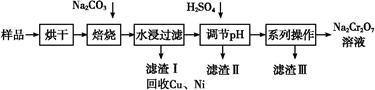
已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。?
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+ 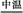 Na2CrO4+ CO2+ ?
Na2CrO4+ CO2+ ?
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。?
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 ?。?
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
?温度
溶解度
化学式
| 20 ℃
| 60 ℃
| 100 ℃
|
Na2SO4
| 19.5
| 45.3
| 42.5
|
Na2Cr2O7
| 183
| 269
| 415
|
Na2CrO4
| 84
| 115
| 126
|
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式 ?。?
参考答案:(1)碱
(2)4Cr(OH)3+4Na2CO3+3O2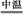 4Na2CrO4+4CO2+6H2O
4Na2CrO4+4CO2+6H2O
(3)Al(OH)3
(4)蒸发浓缩 促进平衡2CrO42—+2H+ Cr2O72—+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
Cr2O72—+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
(5)CrO42—+8H++6e- Cr+4H2O
Cr+4H2O
本题解析:(1)水浸后溶液中含碳酸钠,碳酸根水解显碱性;
(2)空气中的氧气氧化Cr(OH)3且和Na2CO3反应生成Na2CrO4,根据H元素守恒Cr(OH)3中的H会生成H2O,然后根据化合价升降总数相等配平化学方程式。
(3)根据水浸后溶液中存在Al、Zn元素,加入硫酸调节pH会生成Zn(OH)2、Al(OH)3沉淀。
(4)根据表格中数据知Na2CrO4比Na2Cr2O7溶解度小,故应加入硫酸使Na2CrO4转化成Na2Cr2O7,Na2SO4在温度较低时溶解度小更容易结晶析出,故采用蒸发浓缩、冷却结晶、过滤分离Na2SO4。
(5)CrO42—得电子生成Cr,O2-结合H+生成H2O。
本题难度:困难
3、选择题 蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
A.沉淀X的成分是SiO2、Fe2O3
B.从蛇纹石组成看,其成分皆是碱性氧化物
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
参考答案:C
本题解析:
本题难度:一般
4、填空题 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因???,如何用简单方法判断其已洗涤干净??。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是?。

(3)用上图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度
控制在50~60℃之间;④反应管出口端出现了CrCl3升华物
时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→??。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为???。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为???。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是??。
③样品中无水三氯化铬的质量分数为???。
参考答案:

本题解析:略
本题难度:一般
5、选择题 来源:91 考试网;陶瓷、玻璃、水泥等产品的主要成分都是( )
A.硅酸盐
B.二氧化硅
C.硫酸盐
D.碱性氧化物
参考答案:A
本题解析:
本题难度:简单