微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2?(g)=CO2?(g)+2H2O?(l)△H=-890.3kJ?mol-1?①
H2(g)+1/2O2?(g)=H2O?(l)△H=-285.8kJ?mol-1?②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1?③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1?④
反应CH4(g)+H2O(g)
?CO(g)+3H2(g),△H=______kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移______mole-,放出______kJ热量.
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=______,降低温度,K值______(填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是______.(填字母)
a.CH3OH的生成速率与CO的消耗速率相等?b.容器中气体的压强不变
c.容器中混合气体的密度保持不变?d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是______.(填字母)
a.向容器中再充入Ar?b.改变反应的催化剂
c.向容器中再充入CO?d.升高温度.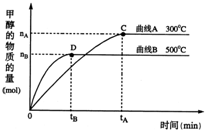
参考答案:(1)由CH4(g)+2O2?(g)=CO2?(g)+2H2O?(l)△H=-890.3kJ?mol-1?①,
H2(g)+1/2O2?(g)=H2O?(l)△H=-285.8kJ?mol-1?②,
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1?③,
H2O(g)=H2O(l)△H=-44.0kJ?mol-1?④,
根据盖斯定律可知,①+④-③-②×3可得CH4(g)+H2O(g)?高温?.??CO(g)+3H2(g),
其反应热△H=(-890.3kJ?mol-1)+(-44kJ?mol-1)-(-283.0kJ?mol-1)-(-285.8kJ?mol-1)×2=+206.1kJ/mol,
标准状况下33.6L甲烷,其物质的量为1.5mol,所以该反应中转移的电子数为1.5mol×(2+4)=9mol,
该反应放出的热量为1.5mol×206.1kJ/mol=309.15kJ,
故答案为:+206.1;9;309.15;
(2)①由CO(g)+2H2(g)?CH3OH(g),则平衡常数K=c(CH3OH)c(CO)?c2(H2),由图可知,温度高时甲醇的量少,则该反应为放热反应,降低温度,平衡正向移动,所以K增大,
故答案为:c(CH3OH)c(CO)?c2(H2);增大;
②由图可知,甲醇在0~tA时间内增加nAmol,则甲醇的反应速率为nA/5tA?mol?(L?min)-1,再由化学计量数之比等于反应速率之比,所以氢气的反应速率为2nA/5tA?mol?(L?min)-1,故答案为:2nA/5tA?mol?(L?min)-1;
③a.CH3OH的生成速率与CO的消耗速率相等,只能确定正反应速率,不能确定正逆反应速率的关系,则不能判断平衡,故a错误;
b.该反应为反应前后压强不等的反应,则容器中气体的压强不变,达到平衡状态,故b正确;
c.因质量、体积不变,则容器中混合气体的密度始终保持不变,不能作为判断平衡的方法,故c错误;?
d.CO百分含量保持不变,浓度不再变化,达到平衡状态,故d正确;
e.CO和CH3OH浓度相等,取决于起始量,不一定达到平衡,故e错误;
故答案为:bd;
④a.体积不变,向容器中再充入Ar,反应体系中各物质的浓度不变,平衡不移动,故a错误;?
b.改变反应的催化剂,不影响化学平衡移动,故b错误;
c.向容器中再充入CO,平衡正向移动,提高氢气的转化率,故c正确;?
d.升高温度提高,平衡逆向移动,H2的转化率减小,故d错误;
故答案为:c.
本题解析:
本题难度:一般
2、简答题 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
(1)合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g);图1表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H______0.(填“>、<或=”下同)
(2)若在230℃时,平衡常数K=1.若其它条件不变,将温度升高到500℃时,达到平衡时,K______1.
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol?CO和7.5mol?H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的______倍.
(4)利用甲醇燃料电池设计如图2所示的装置:
①则该装置中b为______极,写出装置中电解池内发生反应的离子方程式______,
②当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______L.
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式______.

参考答案:(1)根据图示信息,当达到化学平衡以后(甲醇含量的最高点),升高温度,甲醇的体积分数减小,说明平衡逆向移动,所以该反应是一个放热反应,故答案为:<;
(2)对于放热反应,升高温度,K减小,故答案为:<;
(3)根据题意得到:CO(g)+2H2(g)?CH3OH(g)
初始物质的量(mol)? 2.5? 7.5? 0?
变化的物质的量(mol)?2.25? ?4.5? 2.25
平衡的物质的量?(mol)0.25? 3?2.25
所以此时容器内的压强和开始时的比值为:0.25+3+2.252.5+7.5=0.55,故答案为:0.55;
(4)①由图可知,甲醇燃料电池中通入氧气的为正极,b为电池的负极,后边的烧杯为电解池装置,锌与b相连,则锌极为阴极,Cu为阳极,装置相当于在金属锌上镀铜,锌极:Cu2++2e-=Cu,Cu极:Cu=2e-+Cu2+,
故答案为:锌极:Cu2++2e-=Cu,Cu极:Cu=2e-+Cu2+;
?②根据Cu电极反应:Cu=2e-+Cu2+,当铜片的质量变化为12.8g时,转移电子是0.4mol,
a极上电极反应:O2+4e-+2H2O-═4OH-,转移电子是0.4mol时,消耗的O2在标准状况下的体积为2.24L,
故答案为:2.24;
(5)①2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H1=+1411.0kJ/mol
②2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H2=+1366.8kJ/mol
根据盖斯定律反应C2H4(g)+H2O(l)═C2H5OH(l)等于②-①,所以△H=△H2-△H1=-44.2?kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH,△H=-44.2?kJ/mol.
本题解析:
本题难度:一般
3、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol ①
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ/mol ②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H3=-13.7 kJ/mol ③
请回答下列问题:
(1)反应3Fe(s)+2O2(g)=Fe3O4(s)的△H=_____________。
(2)800℃时,C(s)+CO2(g)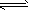 2CO(g)的平衡常数K=1.64,测得高炉内c(CO)= 0. 20 mol/L、c(CO2)=
2CO(g)的平衡常数K=1.64,测得高炉内c(CO)= 0. 20 mol/L、c(CO2)=
0.05mol/L,此时反应向____(填“正”或“逆”)方向进行。
(3)某种矿石中铁元素以氧化物FemOn形式存在(矿石中杂质不与酸反应),现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀H2SO4充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体36 g。剩下滤液用浓度为2
mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。提示:2Fe3++Cu=2Fe2++Cu2+
8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式(m、n为正整数)(请写出计算过程)。
参考答案:(1) -1118. 3 kJ/mol
(3)①解:n(Fe)=5n(KMnO4)=50.025L×2mol/L=0. 25mol
m(Fe)=0.25mol×56g/mol=14g
ω(Fe)=14g/25g×100%=56%
②反应的铜的物质的量n(Cu)=(10g-3.6g)/64g/mol=0.1mol
由方程式得:n(Fe3+)=0.2 mol、n(Fe2+)=0.05 mol
该氧化物的化学式可表示为:Fe5O7或FeO·Fe2O3
本题解析:
本题难度:一般
4、填空题
科学家预测“氢能”将是未来最理想的新能源。请回答下列问题:
(1)实验测得,1g氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为_____
A.2H2(g)+O2(g) =2H2O(l); △H=―142.9 kJ/mol
B.H2(g)+1/2O2(g) =H2O(l); △H =―285.8 kJ/mol
C.2H2(g)+O2(g) = 2H2O(l);△H =―571.6 kJ/mol
D.H2(g)+1/2O2(g) = H2O(g);△H = ―285.8 kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2↑ ③HgBr2+CaO
HgBr2+H2↑ ③HgBr2+CaO HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑ 上述过程的总反应可表示为__________________________。
2Hg+O2↑ 上述过程的总反应可表示为__________________________。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
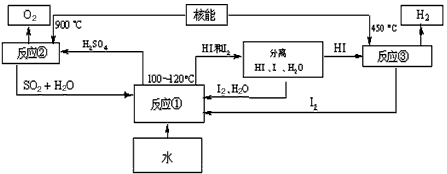
请写出反应①的化学方程式:_______________ 。用硫-碘热循环法制取氢最大的优点是____________。(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由___________________ 。
参考答案:(1)B
(2)2H2O2 H2↑+O2↑
H2↑+O2↑
(3)SO2+I2+2H2O2 HI+H2SO4? ;SO2和I2可循环使用,且无污染。
HI+H2SO4? ;SO2和I2可循环使用,且无污染。
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。)
本题解析:
本题难度:一般
5、选择题 已知:(1)Zn(s)+1/2O2(g)=ZnO(s),△H=-350kJ?mol-1,
(2)2Ag(s)+?1/2O2(g)=Ag2O(s),△H=-25kJ?mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
A.-375?kJ?mol-1
B.-325?kJ?mol-1
C.+375?kJ?mol-1
D.+325?kJ?mol-1
参考答案:B
本题解析:
本题难度:简单