微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,同时符合图像Ⅰ和Ⅱ的是

A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g)  2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C.H2(g)+CO(g) 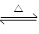 C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
D.4NH3(g)+5O2(g) 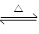 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
参考答案:D
本题解析:A.正反应是放热反应。升高温度,化学反应速率加快,达到平衡所需要的时间缩短。由于该反应的正反应为放热反应。所以当反应达到平衡后,升高温度,平衡逆向移动,生成物的浓度进行。正反应是气体体积减小的反应。增大压强,V正>V逆,平衡正向移动。错误。B.反应2SO3(g)  ?2SO2(g)+O2(g)? ΔH>0的正反应是气体体积增大的吸热反应。在其它条件不变时,升高温度,化学平衡向正反应方向移动,生成物的浓度增大。在其它条件不变时,增大压强,生成物的浓度增大的多,V逆>V正化学平衡向逆反应方向移动。错误。C.H2(g)+CO(g)
?2SO2(g)+O2(g)? ΔH>0的正反应是气体体积增大的吸热反应。在其它条件不变时,升高温度,化学平衡向正反应方向移动,生成物的浓度增大。在其它条件不变时,增大压强,生成物的浓度增大的多,V逆>V正化学平衡向逆反应方向移动。错误。C.H2(g)+CO(g) 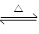 C(s)+H2O(g) ?ΔH>0该反应的正反应为气体体积减小的吸热反应。在其它条件不变时,升高温度,化学平衡向正反应方向移动,生成物的浓度增大。在其它条件不变时,增大压强,生成物的浓度增大的多,V逆>V正化学平衡向逆反应方向移动。错误。D.反应4NH3(g)+5O2(g)
C(s)+H2O(g) ?ΔH>0该反应的正反应为气体体积减小的吸热反应。在其它条件不变时,升高温度,化学平衡向正反应方向移动,生成物的浓度增大。在其它条件不变时,增大压强,生成物的浓度增大的多,V逆>V正化学平衡向逆反应方向移动。错误。D.反应4NH3(g)+5O2(g) 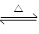 4NO(g)+6H2O(g) ?ΔH<0的正反应是气体体积增大的放热反应。在其它条件不变时,升高温度,平衡逆向移动,生成物的浓度减小。在其它条件不变时,增大压强,V逆>V正,平衡逆向移动,生成物的浓度减小。正确。
4NO(g)+6H2O(g) ?ΔH<0的正反应是气体体积增大的放热反应。在其它条件不变时,升高温度,平衡逆向移动,生成物的浓度减小。在其它条件不变时,增大压强,V逆>V正,平衡逆向移动,生成物的浓度减小。正确。
本题难度:一般
2、简答题 为降低纯净的碳酸钙与稀盐酸反应制取二氧化碳的化学反应速率,可向溶液中加入( )
A.醋酸钠固体
B.浓盐酸
C.氯化钠固体
D.硫酸钠固体
参考答案:A.加入醋酸钠固体,与盐酸反应生成醋酸,醋酸为弱酸,存在电离平衡,氢离子浓度减小,则反应速率降低,故A选;
B.加入浓盐酸,氢离子浓度增大,反应速率加快,故B不选;
C.加入氯化钠固体,对该反应的反应速率无影响,故C不选;
D.加入硫酸钠固体,会结合生成硫酸钙微溶物,包裹在碳酸钙的表面阻止反应的进行,不利用制取二氧化碳,故D不选;
故选A.
本题解析:
本题难度:一般
3、选择题 反应①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0;
FeO(s)+CO(g) ΔH>0;
反应②:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH<0。
FeO(s)+H2(g) ΔH<0。
若反应①在温度T1下进行,反应②在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),下面对两者反应速率大小判断正确的是( )
A.反应①快
B.反应②快
C.一样快
D.无法判断
参考答案:D
本题解析:反应速率主要与反应物的性质有关,这是两个不同的反应,内因为主,外界条件为次,故两者反应速率大小无法比较。
本题难度:一般
4、选择题 下列措施不能够使化学反应速率加快的是( )
A.升高温度
B.降低温度
C.使用催化剂
D.增大固体反应物面积
参考答案:A.升高温度可以使分子运动速率加快,而使反应速率加快,.故A不选;
B.温度降低,反应速率减小,故B选;
C.根据催化剂的定义可以知道,使用合适的催化剂,能够增大化学反应速率,故C不选;
D.增大固体反应物面积,化学反应速率加快,故D不选.
故选B.
本题解析:
本题难度:简单
5、填空题 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。
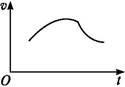
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。?
参考答案:(1)2KClO3+6NaHSO3 3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大
3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大
(2)Cl和HS浓度减小
本题解析:该反应的实质为:Cl+3HS Cl-+3S+3H+
Cl-+3S+3H+
由题意知,反应随溶液中c(H+)的增大而加快,一开始c(H+)很小,速率很小,但随反应进行,c(H+)增大,反应速率增大,但到一定程度后,c(Cl)、c(HS)减小,此时反应物的浓度起主要作用,反应速率减小。
本题难度:一般