微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (13分)Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液进行实验,改变条件如下:
组别
| 10%硫酸的体积(mL)
| 温度/℃
| 其他物质
|
①
| 2 mL
| 20
|
|
②
| 2 mL
| 20
| 10滴饱和MnSO4溶液
|
③
| 2 mL
| 30
|
|
④
| 1 mL
| 20
| 1 mL蒸馏水
|
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
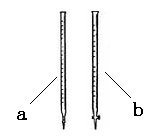
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
参考答案:Ⅰ.(1)①和② (1分) ; ①和③ (1分)
(2)硫酸的浓度或氢离子浓度(2分); 确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变 (2分)
Ⅱ.(1)否 ,KMnO4溶液呈紫色,达滴定终点紫色不再褪去。(2分)
(2)b (2分) (3)75% (3分)
本题解析:Ⅰ.(1)要研究催化剂对化学反应速率的影响,则其它条件应该是相同的,所以应该用实验①和②。同样要研究温度对化学反应速率的影响,其它条件也应该是相同的,所以应该用实验①和③。
(2)对比实验①和④可知硫酸的浓度是不同的,所以可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响。由于实验①中硫酸的体积是2ml,所以为确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变,需要加入1ml水。
Ⅱ.(1)由于酸性KMnO4溶液呈紫色,达滴定终点紫色不再褪去,所以不需要另加指示剂。
(2)酸性高锰酸钾溶液具有强氧化性,能腐蚀橡胶,所以应该用酸式滴定管。
(3)15.00 mL高锰酸钾的物质的量是0.2000mol/L×0.015L=0.003mol,得到电子是0.003mol×5=0.015mol,所以根据电子得失守恒可知,草酸钠的物质的量是0.015mol÷2=0.0075mol,质量是0.0075mol×134g/mol=1.005g,因此质量分数为1.005g÷1.34g×100%=75%。
本题难度:困难
2、选择题 恒温恒容条件下,能使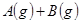

 正反应速率加快的是(?)
正反应速率加快的是(?)
A.减少C或D的物质的量
B.体积不变充入氦气使压强增大
C.减少B的物质的量
D.增大A或B的物质的量
参考答案:D
本题解析:此题考查浓度对反应速率的影响:增大反应物浓度,反应速率加快;题中要求加快正反应速率,即需要增大A或B的浓度,故D正确;
A项,减少C的物质的量,υ(逆)减小,υ(正)不变;减少D的物质的量无影响,因为D为固体,浓度不变;
B项,应体积不变,则A、B浓度不变,故速率不变;
减少B的物质的量,减慢正反应速率,故C错误;
本题难度:一般
3、选择题 下列四种X溶液,均能跟盐酸反应,其中反应最快的是
[? ]
A.10℃ 20 mL 3mol/L的X溶液
B.20℃ 30 mL 2molL的X溶液
C.20℃ 10 mL 4mol/L的X溶液
D.10℃ 10 mL 2mol/L的X溶液
参考答案:C
本题解析:
本题难度:一般
4、选择题 现有下列两个图象:
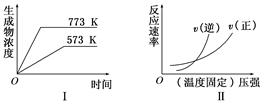
下列反应中符合上述图象的是( ? )
A.N2(g) + 3H2(g) 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g) 2SO2(g) + O2(g) ΔH>0
2SO2(g) + O2(g) ΔH>0
C.4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) ΔH<0
4NO(g) + 6H2O(g) ΔH<0
D.H2(g) + CO2(g)  CO(g) + H2O(g) ΔH>0
CO(g) + H2O(g) ΔH>0
参考答案:B
本题解析:从图Ⅰ可知,升高温度,生成物浓度增大,即平衡向正反应方向移动,说明正反应为吸热反应;从图Ⅱ可知,压强增大,v(逆)>v(正),即平衡向逆反应方向移动,说明逆反应为气体分子数减小的反应,同时满足以上两个条件的只有B选项。
本题难度:简单
5、实验题 某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
实验设计如表:
编号
| T/K
| 大理石规格
| HNO3浓度
|
①
| 298
| 粗颗粒
| 2.00 mol·L-1
|
②
| 298
| 粗颗粒
| 1.00 mol·L-1
|
③
| 308
| 粗颗粒
| 2.00 mol·L-1
|
④
| 298
| 细颗粒
| 2.00 mol·L-1
|
将相应的实验目的填入下列空格中:
(1)实验①和②探究 对该反应速率的影响;
(2)实验①和③探究 对该反应速率的影响;
(3)实验①和④探究 对该反应速率的影响
参考答案:(1)浓度;(2)温度;(3)固体颗粒大小
本题解析:考查外界条件对反应速率的影响。在其它条件不变的情况下,增多反应物浓度或升高温度或增大反应物的接触面积或使用催化剂均能加快反应速率。根据实验中的数据可知①②硝酸的浓度不同,所以是探究浓度对反应速率的影响的。①③中温度不同,所以探究的是温度对反应速率对影响。①④中固体的表面积不同,所以探究的是固体颗粒大小对反应速率影响的。
本题难度:一般