微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用98%的浓H2SO4( )配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是
)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是
① 玻璃棒?② 胶头滴管?③ 100mL容量瓶?④ 托盘天平?⑤ 50mL烧杯?⑥10mL量筒 ⑦ 100mL量筒?⑧ 移液管?
A.⑥③⑧⑤①②
B.⑥⑤③①②
C.④⑤③②①⑨
D.⑥⑤①③②
参考答案:D
本题解析:设需要浓硫酸的体积是V,1.84V·98%/98=0.1,V=5.43ml;
本题难度:简单
2、选择题 进行化学实验时必须要有安全意识,下列做法错误的是
A.加热试管或烧杯时,应首先擦干外壁上的水
B.不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精及其它易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医
参考答案:C
本题解析:A正确,防止试管炸裂;B正确,不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液;C错,温度计摔坏导致水银散落到地面上,应立即用硫粉处理;D正确,小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医;
本题难度:简单
3、选择题 实验室盛装浓硫酸的试剂瓶应贴有的危险品化学标志是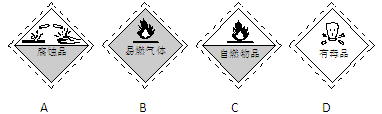
参考答案:A
本题解析:浓硫酸为腐蚀性,所以实验室盛装浓硫酸的试剂瓶应贴有的危险品化学标志是A;
本题难度:简单
4、选择题 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当打开止水夹K,使两烧瓶内气体充分接触后,容器内压强由小到大的顺正确的
是( )
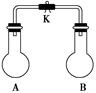
编号
| ①
| ②
| ③
|
A中气体
| H2
| NH3
| NO
|
B中气体
| Cl2
| HCl
| O2
|
A.②③① ?B.③①②? C.③②①?D.②①③
参考答案:A
本题解析:①混合后不反应,压强最大。②反应生成固体氯化铵,压强最小。③反应的方程式为2NO+O2=2NO2,所以反应后体积减小,压强减小。因此正确的答案是A。答案选A。
本题难度:简单
5、填空题 为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为?。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、?。
(3)完成并配平下列离子方程式:?C2O42-+?MnO4-+?H+=?CO2+?Mn2++???
(4)滴定时边滴边摇动锥形瓶,眼睛应观察?。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数?。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是?。
(7)试样中H2C2O4·2H2O的质量分数为?。
参考答案:(12分) (1) c(HC2O4-)>c(C2O42-)>c(H2C2O4) (2分)
(2)胶头滴管、250 mL容量瓶(2分)、(量筒)
(3) 5,2,16? 10,2,8H2O(2分) ?(4) 锥形瓶中溶液颜色变化(1分)
(5) 偏小(1分)? (6) 溶液由无色变成浅紫红色,且半分钟内不褪色(1分)?(7) 21%(3分)
本题解析:(1)已知0.10 mol/L KHC2O4溶液pH约为3,溶液显酸性,这说明HC2O4-的电离程度大于HC2O4-的水解程度。由于不论是水解,还是电离,程度都是很小的,所以溶液中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
(2)实验室配成250 mL试样溶液需要的仪器主要有烧杯、玻璃棒、胶头滴管和250ml容量瓶。
(3)根据反应式可知,C2O42-中碳元素的化合价从+3价升高到+4价,失去1个电子。MnO4-中Mn元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,还原剂C2O42-与氧化剂MnO4-的物质的量之比是5:2,然后根据原子守恒可知,反应中还有水生成,所以配平后的离子方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
(4)滴定实验中准确判断终点是实验的关键,所以滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液颜色变化。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则导致溶液额浓度被稀释,所以消耗氢氧化钠溶液的体积减少,所以测得的H2C2O4·2H2O的质量分数偏小。
(6)由于酸性高锰酸钾溶液在溶液中显紫红色,所以步骤③中判断滴定终点的方法是溶液由无色变成浅紫红色,且半分钟内不褪色。
(7)设H2C2O4·2H2O、KHC2O4的物质的量分别是x 和y。25ml溶液消耗氢氧化钠的物质的量=0.02000L×0.2500 mol/L=0.005000mol,则250ml溶液消耗氢氧化钠的物质的量=0.005000mol×10=0.05000mol,则2x+y=0.05000mol。25ml溶液消耗高锰酸钾的物质的量=0.1000 mol/L×0.01600L=0.001600mol,所以250ml溶液消耗高锰酸钾的物质的量=0.001600mol×10=0.01600mol,则根据电子得失守恒可知,2x+2y=0.01600mol×5=0.08000mol,解得x=0.01000mol、y=0.03000mol,所以试样中H2C2O4·2H2O的质量分数为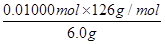 ×100%=21%。
×100%=21%。
本题难度:一般