微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
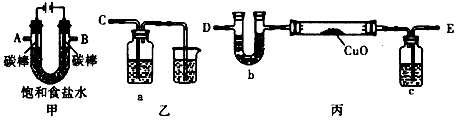
(1)为完成上述实验,正确的连接顺序为A连____;B 连____(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为___________________。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是____________,对应的现象为_____________。
(4)丙装置的c瓶中盛放的试剂为____________,作用是_______________。
(5)精确测量硬质玻璃管的质量为ag,放入CuO后,精确测量硬质玻璃管和CuO的总质量为bg,实验完毕后,为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案。
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量(cg),进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量(dg),进而确定Cu的相对原子质量。
①请你分析并回答:_____方案测得的结果更准确。你认为不合理的方案的不足之处是____________。
②按测得结果更准确的方案进行计算,Cu的相对原子质量为__________。
参考答案:(1)E;C
(2)检验氢气的纯度
(3)淀粉KI溶液;溶液变为蓝色
(4)浓硫酸;吸收H2中的H2O
(5)①甲;空气中的CO2和H2O会通过D进入U形管而造成较大的实验误差
②16(c-a)/(b-c)
本题解析:
本题难度:一般
2、填空题 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
实验药品:9.0g镁铝合金,100mLamol/L稀硫酸,260mL5mol/L氢氧化钠溶液.
实验步骤
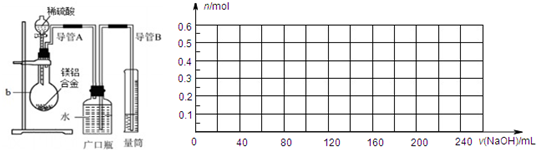
①将9.0g镁铝合金与100mLamol/L稀硫酸在图所示装置中充分反应至反应完毕,并收集生成的全部气体.
②向b内的混合液中逐滴加入260mL5mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液滴加至200mL时生成的沉淀量最大.
问题讨论
(1)仪器b的名称是______.
(2)根据实验目的可知,9.0g镁铝合金与100amol/L稀硫酸反应时,应该过(足)量的物质是______(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余.
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是______.
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个主要问题是:一是要______,二是要调整量筒液面与广口瓶液面相平,三是要使视线与量筒内的凹液面相平.
(5)若标准状况下,由实验步骤①得到的气体体积为10.08L,则合金中镁的质量分数为______.
(6)在“amol/L稀硫酸”中a的值为______.
(7)请在图中画出实验步骤②中生成沉淀的物质的量(n)随加入氢氧化钠溶液的体积[v(NaOH)]的变化曲线.
参考答案:(1)实验装置中用于硫酸和合金反应的容器是原地烧瓶,故答案为:圆底烧瓶;
(2)根据实验目的可知测定合金中镁铝的质量分数,实验式需要合金全部反应,所以需要稀硫酸过量,故答案为:稀硫酸;
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时发生的反应为:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;分析反应得到产生最大量测定后的溶质为Na2SO4,故答案为:Na2SO4;
(4)排水量气法需要注意水要冷却至室温,调整量筒液面与广口瓶液面相平,使视线与量筒内的凹液面相平,故答案为:冷却至室温;
(5)若标准状况下,由实验步骤①得到的气体体积为10.08L,依据反应计算:设镁物质的量为X,铝物质的量为Y;生成氢气物质的量=10.08L22.4L/mol=0.45mol;
Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;
X X Y 1.5Y
X+1.5Y=0.45
24X+27Y=9
解方程得到:X=0.15mol;Y=0.2mol;
则镁的质量分数=0.15mol×24g/mol9.0g×100%=0.4,
故答案为:0.4;
(6)f反应过程中生成最大量沉淀时,依据化学方程式分析判断,相当于硫酸和氢氧化钠全部反应,依据氢离子和氢氧根离子物质的量相同列式:
100mLamol/L稀硫酸和200mL5mol/L氢氧化钠溶液恰好反应,0.1×a=0.2×5,a=5,故答案为:5;
(7)硫酸物质的量=0.1L×5mol/L=05mol;Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;依据上述计算得到剩余硫酸=0.5mol-0.15mol-0.3mol=0.05mol,消耗氢氧化钠体积=0.05mol×25mol/L=0.02L=20ml;生成最大量测定需要氢氧化钠物质的量=0.15mol×2+0.2mol×3=0.9mol,消耗氢氧化钠溶液体积=0.9mol5mol/L=0.18l=180ml;沉淀氢氧化铝全部溶解发生反应:Al(OH0)3+OH-=AlO2-+2H2O;需要氢氧化钠物质的量为0.2mol,体积为40ml;共消耗氢氧化钠溶液体积=20ml+180ml+40ml=240mol;依据沉淀最大量为0.35mol;氢氧化镁沉淀为0.15mol;结合图象画法,描点画出图象为
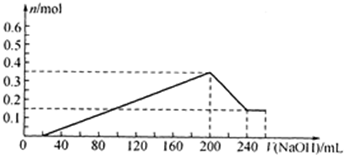 ,故答案为:
,故答案为: .
.
本题解析:
本题难度:一般
3、选择题 甲、乙、丙、丁各是BaCl2、Na2CO3、AgNO3、HCl四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色气体;则下列判断正确的是( )
A.甲是BaCl2
B.丁是Na2CO3
C.乙是AgNO3
D.丙是HCl
参考答案:根据题意知,乙+丁→无色气体,说明乙和丁中的一种是碳酸钠,一种是盐酸;甲、乙、丁都能和丙反应生成沉淀,能和另外三种物质生成沉淀的是硝酸银,则丙是硝酸银;甲+乙→沉淀,甲是氯化钡,因为乙和丁中的一种是碳酸钠一种是盐酸,则乙是碳酸钠,所以丁是盐酸.
故选A.
本题解析:
本题难度:简单
4、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全不正确的是(? )
A.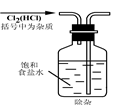 B?
B?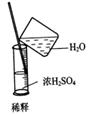 ?C
?C ? D.
? D.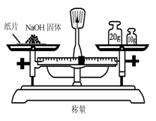
参考答案:ABD
本题解析:A、该操作会造成食盐水倒吸。
B、浓硫酸稀释的正确做法是将浓硫酸倒进水中。
D、用天平称量物品时,要注意是“左物右码”,因为NaOH有很强的吸湿性,很容易吸收空气中的水蒸气而潮解,直接暴露在空气中称量的话会造成误差除此外,还因为NaOH会和空气中的二氧化碳反应,生成NaCO3,降低样品的纯度,所以,可以用称量瓶来称量。
点评:此题考核了常见实验操作方法,要求学生平时的实验操作动作要规范,正确。
本题难度:简单
5、实验题 十.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望。
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性。
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生; Ⅱ. 取样品少许,加水溶解后,滴入酚酞显红色; Ⅲ.按下图所示过程,进一步实验

请你与小王同学一道完成下列问题的分析解答
(1)氢氧化钠变质的化学反应方程式是_________________________。
(2)开始两个步骤中的实验操作a、b,都要使用的两件玻璃仪器是_____________。
(3)步骤b中,不能用Ca(OH)2代替CaCl2的原因是(用化学方程式表示原因):_____________________
(4)根据上述实验,若直接测定wg样品中氢氧化钠的质量而求其质量分数,须测定的数据是________
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量
参考答案:(1)2NaOH+CO2==Na2CO3+H2O
(2)玻璃棒和烧杯?
(3)Ca(OH)2+Na2CO3==CaCO3↓+2NaOH,会影响对NaOH存在的判断
(4)C
本题解析:
本题难度:困难