微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
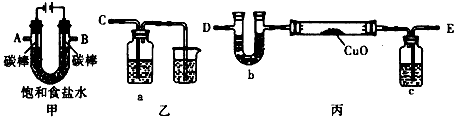
(1)为完成上述实验,正确的连接 顺序为A连____;B 连____(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为___________________。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是____________,对应的现象为_____________。
(4)丙装置的c瓶中盛放的试剂为____________,作用是_______________。
(5)精确测量硬质玻璃管的质量为ag,放入CuO后,精确测量硬质玻璃管和CuO的总质量为bg,实验完毕后,为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案。
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量(cg),进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量(dg),进而确定Cu的相对原子质量。
①请你分析并回答:_____方案测得的结果更准确。你认为不合理的方案的不足之处是____________。
②按测得结果更准确的方案进行计算,Cu的相对原子质量为__________。
2、填空题 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
实验药品:9.0g镁铝合金,100mLamol/L稀硫酸,260mL5mol/L氢氧化钠溶液.
实验步骤
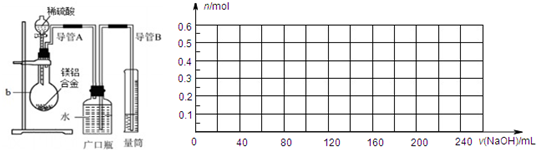
①将9.0g镁铝合金与100mLamol/L稀硫酸在图所示装置中充分反应至反应完毕,并收集生成的全部气体.
②向b内的混合液中逐滴加入260mL5mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液滴加至200mL时生成的沉淀量最大.
问题讨论
(1)仪器b的名称是______.
(2)根据实验目的可知,9.0g镁铝合金与100amol/L稀硫酸反应时,应该过(足)量的物质是______(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余.
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是______.
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个主要问题是:一是要______,二是要调整量筒液面与广口瓶液面相平,三是要使视线与量筒内的凹液面相平.
(5)若标准状况下,由实验步骤①得到的气体体积为10.08L,则合金中镁的质量分数为______.
(6)在“amol/L稀硫酸”中a的值为______.
(7)请在图中画出实验步骤②中生成沉淀的物质的量(n)随加入氢氧化钠溶液的体积[v(NaOH)]的变化曲线.
3、选择题 甲、乙、丙、丁各是BaCl2、Na2CO3、AgNO3、HCl四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色气体;则下列判断正确的是( )
A.甲是BaCl2
B.丁是Na2CO3
C.乙是AgNO3
D.丙是HCl
4、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全不正确的是(? )
A.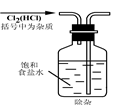 B?
B? ?C
?C ? D.
? D.
5、实验题 十.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望。
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性。
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生; Ⅱ. 取样品少许,加水溶解后,滴入酚酞显红色; Ⅲ.按下图所示过程,进一步实验

请你与小王同学一道完成下列问题的分析解答
(1)氢氧化钠变质的化学反应方程式是_________________________。
(2)开始两个步骤中的实验操作a、b,都要使用的两件玻璃仪器是_____________。
(3)步骤b中,不能用Ca(OH)2代替CaCl2的原因是(用化学方程式表示原因):_____________________
(4)根据上述实验,若直接测定wg样品中氢氧化钠的质量而求其质量分数,须测定的数据是________
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量