|
高中化学知识点讲解《无机综合与推断》高频考点强化练习(2017年最新版)(六)
2017-07-18 01:40:46
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
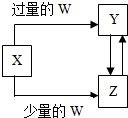
1、选择题 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
| 选项 | W | X
A
盐酸
Na2CO3溶液
B
Cl2
Fe
C
CO2
Ca(OH)2溶液
D
NH3?H2O
AlCl3溶液
|
A.A
B.B
C.C
D.D
| 
参考答案:BD
本题解析:
本题难度:简单
2、推断题 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:

⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为__________________________。
⑵若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为___________。
⑶若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)_____________________________。
⑷若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为______________________。
⑸若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为______。
⑹若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为___________。
⑺若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式为____________________。
参考答案:⑴
⑵
⑶加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe===3Fe2+
⑷CO2+CO32-+H2O==2HCO3-
⑸AlO2-
⑹O=C=O
⑺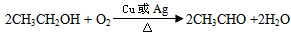
本题解析:
本题难度:一般
3、填空题 下图所示各步变化,A为金属,B为淡黄色固体粉末,每一物质均含有A元素。(8分)
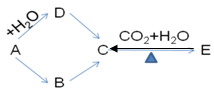
(1)?写出下列物质的化学式:B?C?D?E?
(2)?写出下列步骤的化学反应方程式
A→B:?
B→C:??
(3)?写出下列步骤的离子反应方程式
A→D:??
参考答案:(1)B Na2O2? C Na2CO3? D? NaOH? E? NaHCO3?(每空0.5分)
(2). A→B:? 2Na + O2 Na2O2 ?(2分) Na2O2 ?(2分)
B→C:? 2Na2O2?+ 2CO2?= 2Na2CO3?+ O2(2分)
(3). A→D:? 2 Na+2H2O? = 2Na+ +2OH-? + H2 ↑ (2分)
本题解析:中学化学中只有Na2O2和S为淡黄色粉未,且已知A为金属,所以得到,B为Na2O2,A为Na,? D为NaOH ,由B ,D都可转化为C,且E在加热的条件下生成C,得C为Na2CO3?,E为NaHCO3。
点评:本题以化学推断题的形式考查了钠及其化合物之间的转化,而做推断题的重点就是找到突破口,本题其中,淡黄色粉未就是本题的突破口,而对钠与其化合物之间的转化的掌握是解答本题的基础。
本题难度:一般
4、简答题 如图,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
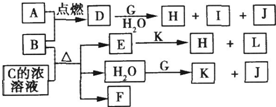
回答下列问题:
(1)K名称为______,所含的化学键有______.
(2)①D的水溶液呈棕黄色,则D的水溶液与G反应的离子方程式为______.
②少量B与C的浓溶液加热时反应的化学方程式为______
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为______(填代号).
A.c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)
B.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-)
C.c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
D.c(OH-)>c(H+)
②若将标准状况下2.24L的F通入150mL1mol?L-1的K溶液中.则所得溶液中各粒子浓度关系满足的上述关系式为______(填代号).
参考答案:由J的元素原子核内只有一个质子知J为H2;I的焰色反应为黄色,所以I含Na元素;由金属B在A气体中燃烧产生棕黄色烟可知A为Cl2,B为Fe或Cu,则D为FeCl3或CuCl2,;
且D+G+H2O→H+I+J,结合I含Na元素知G为金属钠,且H2O+G→K+J(H2),所以K为NaOH,D的水溶液呈棕黄色,则D为FeCl3,其水溶液与Na的反应为:6Na+2FeCl3+6H2O═2Fe(OH)3↓+6NaCl+3H2↑,F为无色、有刺激性气味气体,且能使品红溶液褪色,应为SO2,则C为H2SO4,E为Fe2(SO4)3,H为Fe(OH)3,L为NaCl,
(1)由以上分析可知,K为NaOH,名称为氢氧化钠;所含化学键为离子键和共价键;故答案为:氢氧化钠;离子键、共价键;
(2))①D的水溶液呈棕黄色,D为FeCl3,在氯化铁溶液中加入金属钠,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,则FeCl3的水溶液与Na反应的离子方程式为:Fe3++6H2O+6Na=2Fe(OH)3↓+6Na++3H2↑或2Na+2H2O═2Na++2OH-+H2↑,Fe3++3OH-=Fe(OH)3↓,
故答案为:2Fe3++6H2O+6Na=2Fe(OH)3↓+6Na++3H2↑或2Na+2H2O═2Na++2OH-+H2↑,Fe3++3OH-=Fe(OH)3↓;
②少量B为Fe与C为H2SO4,少量铁在与浓硫酸在加热条件下反应生成硫酸铁和二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O;
故答案为:2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O;
(3)①若将F为SO2通入一定量K为NaOH的水溶液中,反应生成亚硫酸钠溶液,或亚硫酸氢钠溶液,或二者混合物,则所得溶液中各离子浓度一定满足的下列关系式为:
A.溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-);溶液中一定存在电荷守恒,故A一定;
B.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-),生成的盐溶液是Na2SO3时物料守恒为c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-),若是NaHSO3溶液存在物料守恒为:.c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),若是Na2SO3和NaHSO3的混合溶液,存在的物料守恒为:2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-);故B不一定;
C.c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),离子浓度大小是硫酸氢钠溶液中的离子浓度大小,若生成的是亚硫酸钠溶液时,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3),故C不一定;
D.c(OH-)>c(H+)溶液中生成的盐溶液是Na2SO3,强碱弱酸盐水解显碱性,c(OH-)>c(H+);若是NaHSO3,溶液中亚硫酸根离子电离程度大于亚硫酸氢根离子的水解,溶液呈酸性,c(OH-)<c(H+),故D不一定;
故答案为:A.
②若将标准状况下2.24L的SO2通入150mL1mol?L-1的NaOH溶液中.n(SO2)=0.1 mol;n(NaOH)=0.15mol;n(SO2):n(NaOH)=2:3,反应后生成了亚硫酸钠和亚硫酸氢钠的混合溶液,反应的化学方程式为:2SO2+3NaOH=Na2SO3+NaHSO3+H2O;则所得溶液中各粒子浓度关系满足的上述关系式:
A、一定符合溶液中的电荷守恒,故A符合;
B、Na2SO3和NaHSO3的混合溶液,存在的物料守恒为:2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-);故B符合;
C、反应得到的是同浓度的亚硫酸钠和亚硫酸氢钠的混合溶液,溶液中亚硫酸氢根离子电极程度大于亚硫酸根离子水解程度,故溶液显酸性,溶液中离子浓度大小为c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3),故C不符合;
D、反应得到的是同浓度的亚硫酸钠和亚硫酸氢钠的混合溶液,溶液中亚硫酸氢根离子电极程度大于亚硫酸根离子水解程度,故溶液显酸性,c(OH-)<c(H+),故D不符合;
故答案为:AB.
本题解析:
本题难度:一般
5、填空题 (10分)A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如右图所示。
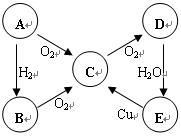
(1)如果A是淡黄色固体,
①写出B、E的化学式:B 、E ? 。
②C→D的化学方程式为_____________________。
③将足量的物质C通过入BaCl2溶液中,下列说法正确的是___________(填字母序号)。
a.溶液没有明显变化
b.溶液中出现白色浑浊
c.若继续通入Cl2或NH3,溶液都出现白色浑浊
(2)如果A是无色气体:
D→E的化学方程式为 ?;
E→C的离子方程式为 ?。
参考答案:(1小题①2分,其余每空2分)
(1)①H2S、H2SO4?②2SO2+O2 2SO3?③ a c 2SO3?③ a c
(2)3NO2+H2O=2HNO3+NO?3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
本题解析:略
本题难度:简单
| 