微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)已知金属单质A是生产生活中用量最大的金属。 D是难溶于水的白色固体。 F为红褐色固体。无色气体甲遇气体丙立即生成红棕色的气体乙。(图中部分产物和反应的条件略)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式C__________G__________。
写出反应①的化学方程式________________________________ 。
反应②的离子方程式_____________________________。
(3)反应④整个过程观察到的现象为_____________________________。
(4)反应⑤中,若将充满气体乙的试管倒扣在水槽中,充分反应后,试管内液体占试管总体积_______________。
(5)某种贫血症患者应补充C物质的阳离子。含该离子的药片外表包有一层特殊的糖衣,这层糖衣的作用就是保护该离子不被空气中的氧气氧化。为检验长期放置的药片已经失效,将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,然后滴加数滴__________溶液,溶液显__________色,表明该药片已失效。
参考答案:(1)Fe(NO3)2、Na2O2;(2)4HNO3+Fe=Fe(NO3)3+NO↑+2H2O;Fe + 2Fe3+ = 3Fe2+;
(3)白色沉淀迅速变为灰绿色,最后变为红褐色;(4)2/3;(5)硫氰酸钾?红
本题解析:根据题意知,金属单质A是生产生活中用量最大的金属,则A为铁;F为红褐色固体,则F为氢氧化铁;无色气体甲遇气体丙立即生成红棕色的气体乙,则甲为一氧化氮,丙为氧气,乙为二氧化氮;结合题给转化关系图及相关物质的性质知,B为硝酸铁,C为硝酸亚铁,D为氢氧化亚铁,E为硝酸,H为氢氧化钠,G为过氧化钠。(1)根据上述分析知,C为硝酸亚铁,G为过氧化钠,化学式分别为Fe(NO3)2、Na2O2;(2)反应①为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,化学方程式为4HNO3+Fe=Fe(NO3)3+NO↑+2H2O;反应②为硝酸铁与铁反应生成硝酸亚铁,离子方程式为Fe + 2Fe3+ = 3Fe2+;(3)反应④为氢氧化亚铁被空气中的氧气氧化为氢氧化铁,整个过程观察到的现象为白色沉淀迅速变为灰绿色,最后变为红褐色;(4)反应⑤为二氧化氮与水反应生成硝酸和一氧化氮,根据化学方程式3NO2+H2O=2HNO3+NO判断,充分反应后,试管内液体占试管总体积的2/3;(5)根据题意知,贫血症患者应补充C物质的阳离子为亚铁离子,被空气中的氧气氧化转化为铁离子,为检验长期放置的药片已经失效,将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,然后滴加数滴硫氰酸钾溶液,溶液显红色,表明该药片已失效。
本题难度:一般
2、填空题 A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:?
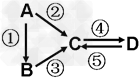
(1)、若A是硫磺,B是气态氢化物,C是造成酸雨的污染物之一,④反应是通一种黄绿色气体,生成D和另一种产物E,D是一种含氧酸,写出反应④的化学反应方程式:_____ ______? ;检验④反应产物E中阴离子所用试剂为:? 。
(2)、若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写④反应离子方程式? ? ;利用A的还原性和A转化为氧化物时能放出大量热的性质,工业上常用A来还原一些金属氧化物,写出这类反应在工业上的一个重要应用(用方程式表示)? 。
(3)、若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液常用于制作印刷电路板,写出该反应的离子方程式? 。
参考答案:(1) 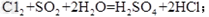
 溶液,稀
溶液,稀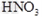 (只答
(只答 溶液不给分)
溶液不给分)
(2) AlO2- +2H2O+CO2==Al(OH)3 ↓+ HCO3-?2 Al+Fe2O3====2Fe+Al2O3?
(3)?Cu+2Fe3+=Cu2+ +2Fe2+
本题解析:
本题难度:一般
3、填空题 如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物.按要求回答下列问题:
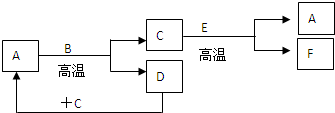
(1)E在元素周期表中位于第______周期;第______族.
(2)写出A和B反应的化学方程式:______.
(3)C和E反应的化学反应方程式为______.
参考答案:B是化合物且常温下为液态,应为H2O,A为金属,和H2O在高温下发生反应,应为Fe和水的反应,则A为Fe,C为Fe3O4,和E在高温下发生反应生成F,F为两性化合物,应为Al2O3,E为Al,D为H2,
(1)E为Al,原子序数为13,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期ⅢA族,故答案为:三;ⅢA;
(2)Fe和H2O在高温下反应生成Fe3O4和H2,反应的方程式为3Fe+4?H2O(g)?高温?.?Fe3O4+4H2,故答案为:3Fe+4?H2O(g)?高温?.?Fe3O4+4H2;
(3)Al和Fe3O4在高温下发生铝热反应,反应的方程式为3Fe3O4+8Al?高温?.?4Al2O3+9Fe,故答案为:3Fe3O4+8Al?高温?.?4Al2O3+9Fe.
本题解析:
本题难度:一般
4、填空题 (8分)W、X、Y、Z四种化合物的焰色反应均为黄色,它们之间存在如下关系:
①W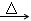 X+CO2↑+H2O
X+CO2↑+H2O
②Z+CO2 X+O2
X+O2
③Z+H2O Y+O2↑
Y+O2↑
④X+Ca(OH)2 Y+CaCO3↓
Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W?、X?、Y?、Z?。
(2)以上4个化学反应,属于氧化还原反应的是?(填反应序号),反应中氧化剂是
?(写化学式),还原剂是?(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应方程式:
①?。②?。
参考答案:(1)NaHCO3? Na2CO3? NaOH? Na2O2?(2)②③? Na2O2? Na2O2
(3)①Ca2++CO32-=CaCO3↓? ②Ca(OH)2+K2CO3=2KOH+CaCO3↓(合理即可)
本题解析:四种化合物的焰色反应均为黄色,四种化合物均为钠的化合物。①反应可认定为
NaHCO3的分解反应:2NaHCO3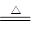 Na2CO3+CO2↑+H2O,该反应是非氧化还原反应。由X(Na2CO3)逆推可知Z为Na2O2,Y为NaOH:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以上两个反应都是氧化还原反应,且Na2O2既是氧化剂又是还原剂。这样,④反应为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,其离子反应为Ca2++CO32-=CaCO3↓,多数可溶性碳酸盐和Ca(OH)2的反应都可用此离子方程式表示,该反应不是氧化还原反应。
Na2CO3+CO2↑+H2O,该反应是非氧化还原反应。由X(Na2CO3)逆推可知Z为Na2O2,Y为NaOH:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以上两个反应都是氧化还原反应,且Na2O2既是氧化剂又是还原剂。这样,④反应为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,其离子反应为Ca2++CO32-=CaCO3↓,多数可溶性碳酸盐和Ca(OH)2的反应都可用此离子方程式表示,该反应不是氧化还原反应。
本题难度:一般
5、填空题 已知四种元素A、B、C、D 为1到20号元素,且原子序数依次增大,A的核外电子数与其电子层数相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。请回答下列问题:
(1) C在周期表中的位置第?______周期 ,第________族;
,第________族;
(2 ) 写出铜与稀HBO3溶液反应的离子反应方程式?
) 写出铜与稀HBO3溶液反应的离子反应方程式?
(3) A、B形成的化合物的结构式____?;其中含有的化学键类型为________,用电子式表示该化合物形成过程?___?_。
(4)写出D与C形成化合物的电子式____?____。
参考答案:(方程式2分,其余每空1分,共8分)
(1)三(1分)?ⅥA(1分,不写A者不给分)
(2)3Cu + 8H+ +2NO3-=" =" 3Cu2++ 2NO↑ + 4H2O
(2分,化学式有错者得0分,未配平者扣1分。不标气体符号的扣1分)
(3) (1分)极性键(1分),有错别字者不给分)
(1分)极性键(1分),有错别字者不给分)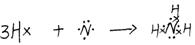 (1分)
(1分)
(4) (1分)
(1分)
本题解析:略
本题难度:一般