微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于碱金属元素的叙述错误的是
A.随核电荷数递增,碱金属单质的熔沸点逐渐减小
B.随核电荷数递增,碱金属单质的密度逐渐增大(Na、K反常)
C.碱金属元素包括F、Cl、Br、I、At五种元素
D.碱金属元素的原子最外层都只有一个电子
参考答案:C
本题解析:碱金属元素位于第IA,包括Li、Na、K、Rb、Cs、Fr。所以选项C是错误的,答案选C。
本题难度:简单
2、选择题 某元素的原子的最外层电子数是其次外层电子数的3倍,则此元素是
A.硫
B.碳
C.氧
D.铝
参考答案:C
本题解析:考查原子核外电子的排布。因为元素原子的最外层电子数不超过8(K层为最外层时不超过2个),所以最外层电子数是其次外层电子数的3倍的原子只能是两层,因此是氧元素。
本题难度:一般
3、填空题 (12分
下图是元素周期表的一部分:

⑴表中区域名称s、p……等确定的依据是_______________________________________。
⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。
⑶上表中元素x的一种氢化物的晶体结构如图所示,写出该化合物在氯气中燃烧的化学方程式?。
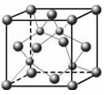
除x外,第四周期中最外层只有一个电子的还有?(填元素名称)。
⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛(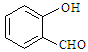 )和对羟基苯甲醛(
)和对羟基苯甲醛(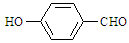 ),前者沸点低于后者,理由是
),前者沸点低于后者,理由是
? _____?。
参考答案:(12分)
⑴根据构造原理最后填入电子的能级的符号(2分)

本题解析:
(1)根据构造原理最后填入电子的能级的符号。
(2)列表分析? K? L? M? N
A? 2? 8? 11? 2
B? 2? 8? 18? 6
A的电子排布式为:1s22s22p63s23p63d34s2,B为第四周期ⅣA族锗;
(3)由图可知:晶胞中Cu?原子个数为8×1/8+6×1/2=4,H原子个数为4,所以化学式为CuH,,在Cl2中燃烧的方程式为:2CuCl+3Cl2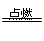 2CuCl2+2HCl;
2CuCl2+2HCl;
除Cu外,第四周期中最外层只有一个电子的还有钾与铬,[Ar]4s1? [Ar]3d54s1
(4)邻羟基苯甲醛存在分子内氢键,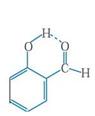 而对羟基苯甲醛存在分子间氢键
而对羟基苯甲醛存在分子间氢键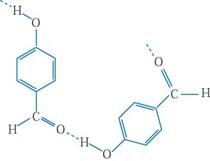
本题难度:一般
4、选择题 已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是(?)
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
参考答案:D
本题解析:第三周期元素的次外层有8个电子,最内层有2个电子,二者之差为6。因为该原子达到8电子稳定结构需要的电子数小于6,则需要的电子数为2或4。若为2,则X为S;若为4,则X为Si,硅酸为弱酸,A错;硅的氢化物为SiH4,B错;S单质不能作半导体材料,C错;SO2、SO3和SiO2都能与烧碱反应,D正确。
本题难度:一般
5、选择题 下列判断错误的是
A.稳定性:NH3>PH3>AsH3
B.原子半径:N>P>As
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
参考答案:B
本题解析:非金属性越强气态氢化物越稳定,A正确。原子半径N<P<As,B错误。非金属性越强对应的最高价氧化物的水化物的酸性越强,C正确。金属性越强对应的最高价氧化物的水化物的碱性越强,D正确。
本题难度:一般