微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 反应3Fe(S)+4H2O═Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率______,逆反应速率______.
③保持体积不变,充入N2使体系压强增大,其正反应速率______,逆反应速率______.
④保持压强不变,充入N2使容器的体积增大,其正反应速率______,逆反应速率______.
参考答案:①因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率,故答案为:不变.
②容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,故答案为:增大; 增大.
③体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变,故答案为:不变;不变.
④压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,故答案为:减小;减小.
本题解析:
本题难度:一般
2、选择题 在一定条件下的反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是( )
A.升温
B.加压
C.减压
D.加催化剂
参考答案:A.升温,反应速率加快,但该反应为放热反应,升温平衡逆向移动,故A不选;
B.该反应为气体气体缩小的反应,加压,反应速率加快,平衡正向移动,故B选;
C.减压,反应速率减小,平衡逆向移动,故C不选;
D.催化剂能加快反应速率,对平衡移动无影响,故D不选;
故选B.
本题解析:
本题难度:一般
3、选择题 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
A.逸出ClO2使生成物浓度降低
B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用
D.溶液中的Cl-起催化作用
参考答案:D
本题解析:向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,而盐酸于稀硫酸的不同之处在于酸根,这说明反应中生成的氯离子对反应起到催化剂的作用,答案选D。
点评:该题主要是考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力,属于中等难度的试题。
本题难度:一般
4、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不一定使反应速率加快的是(?)
A.增加硫酸的浓度
B.加热
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
参考答案:A
本题解析:考查外界条件对反应速率的。增加硫酸的浓度可以加快反应速率,当如果浓度太大,硫酸将变为浓硫酸,此时和铁会发生钝化,即使加热也不能再生成氢气,所以答案选A。
本题难度:一般
5、填空题 (14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。?
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。?
(1)写出滴定过程中发生反应的化学方程式为???。?
(2)滴定过程中操作滴定管的图示正确的是???。
 ?
?
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度??(填“偏高”、“偏低”、或“不变”)。?
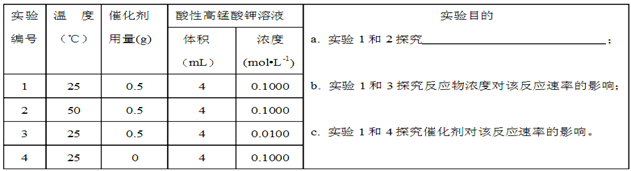
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1?。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
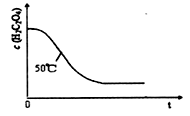
(4)写出表中a?对应的实验目的???;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线?如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。?
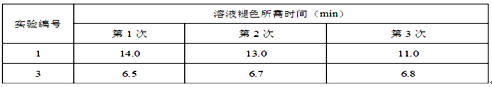
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):?
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案?______________________。?
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为??。
参考答案:(1)? 2MnO4—+5H2C2O4+6H+=?2Mn2+?+?10CO2?↑+?8H2O?;(2) A;(3)?偏高?;
(4)探究温度不同对反应速率的影响
25℃?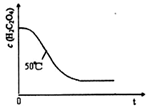 ?
?
(5)其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。?
(6)2MnO4—+?10Cl—?+?16H+?=?5Cl2↑+?2Mn2+?+?8H2O
本题解析:(1) 酸性KMnO4有强氧化性,而草酸有还原性,二者发生氧化还原反应。离子方程式为: 2MnO4—+5H2C2O4+6H+=?2Mn2+?+?10CO2?↑+?8H2O?;(2)滴定过程中操作酸式滴定管的方法是图示的A。(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,则消耗的酸性KMnO4标准溶液读数偏大,以此为标准计算的草酸溶液浓度?就偏高。(4)由于a点对应的其它条件都相同,只有温度不同,因此表中a?对应的实验目的是探究温度不同对反应速率的影响。(5)甲同学改进的实验方案是其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。?溶液褪色时间越短,则反应速率越快。(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因是Cl-有还原性,也会与酸性KMnO4标准溶液反应,而影响实验结果的测定,可用离子方程式表示为2MnO4— +?10Cl— +?16H+?=?5Cl2↑+?2Mn2+?+?8H2O?。
本题难度:一般