微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 R2O 在一定条件下可以把Mn2+氧化成MnO
在一定条件下可以把Mn2+氧化成MnO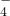 ,若反应后R2O
,若反应后R2O 转变为RO
转变为RO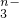 .又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:分析:Mn元素失去的电子数等于R元素得到的电子数(也可以通过化合价计算,Mn升高的化合价的数目等于R元素降低的化合价数目).
解答:反应中R元素化合价由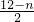 降低到6-n价,根据氧化剂和还原剂得失电子数目相等可知5×[
降低到6-n价,根据氧化剂和还原剂得失电子数目相等可知5×[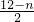 -(6-n)]×2=2×(7-2),n=2,
-(6-n)]×2=2×(7-2),n=2,
故选B.
点评:本题考查氧化还原反应的计算,注意从元素化合价变化的角度计算,明确元素的化合价为解答该题的关键.
本题难度:简单
2、填空题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1
CH3CH=CH2(g) ?CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1
?CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1
则相同条件下,反应C3H8(g) ?CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
?CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3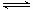 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_______________________(用离子方程式和必要的文字说明)。
参考答案:(1)124.2。
(2)C3H8+5O2 3CO2+4H2O;负。
3CO2+4H2O;负。
(3)4.2×10-7 mol·L-1。
(4)> ;HCO3-+H2O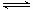 CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3-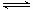 CO32-+H+)。
CO32-+H+)。
HCO3-+H2O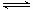 H2CO3+OH-、HCO3-的水解程度大于电离程度
H2CO3+OH-、HCO3-的水解程度大于电离程度
本题解析:(1)由盖斯定律可知,由上一个反应减去下一个反应:C3H8(g)===CH3CH=CH2(g)+H2(g) 得:△H=124.2kJ·mol-1。
(2)注意电池反应不是电极反应,这是本题的关键。电池反应为:C3H8+5O2===3CO2+4H2O,由于CO32-为阴离子,所以它应向负极移动。
(4)由于0.1 mol·L-1NaHCO3溶液的pH大于8,说明溶液呈碱性,进一步推测可知,HCO3-的水解大于HCO3-的电离。
本题难度:一般
3、填空题 下表为元素周期表的一部分:
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
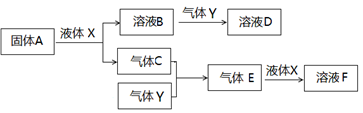
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
参考答案:Ⅰ.(1)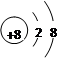 (1分) (2)S2->O2-> Na+(2分) (3)SiCl4
(1分) (2)S2->O2-> Na+(2分) (3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH
本题解析:
本题难度:困难
4、填空题 (15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
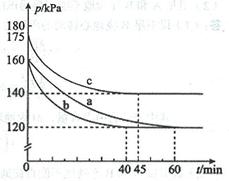
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
;实验a和c的平衡转化率:αa为 、αc为 。
参考答案:
⑴AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1(2分)
⑵① (3 分)
(3 分)
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变(2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1-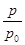 ) (2分) 50%(1分) 40% (1分)
) (2分) 50%(1分) 40% (1分)
本题解析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
平衡时n/mol:: 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
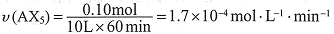
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
变化量n/mol:: 0.20α 0.20α 0.20α
平衡时n/mol:: 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有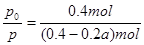 ,化简得α=2(1-
,化简得α=2(1-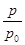 );
);
将图中p0、p的数据代入上述计算式得αa=2(1-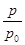 )=2(1-
)=2(1-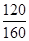 )=50%;
)=50%;
αc=2(1-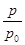 )=2(1-
)=2(1-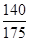 )=40%。
)=40%。
考点:本题考查热化学方程式的书写,化学反应速率的计算,化学平衡移动原理的应用,转化率的计算等。
本题难度:困难
5、选择题 实验室由MnO2和浓盐酸制取纯净的氯气时,气体通过两个洗气瓶,第二个洗气瓶应盛(?)
A.稀盐酸
B.浓硫酸
C.水
D.饱和食盐水
参考答案:B
本题解析:实验室由MnO2和浓盐酸制取纯净的氯气时,气体通过两个洗气瓶,第一个洗气瓶应盛饱和食盐水,第二个洗气瓶应盛浓硫酸。
本题难度:简单