微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列无色透明溶液中,能大量共存的离子组是
A.Cu2+,Na+,SO42-,Cl-
B.K+,Na+,HCO3-,NO3-
C.OH-,HCO3-,Ca2+,Na+
D.Mg2+,Na+,OH-,NO3-
参考答案:B
本题解析:分析:根据离子之间能结合生成水、气体、沉淀等,则离子能大量共存,并结合离子的颜色来解答.
解答:A.该组离子之间不反应,能共存,但Cu2+为蓝色,与无色溶液不符,故A不选;
B.该组离子之间不反应,能共存,且离子均为无色,故B选;
C.因OH-、HCO3-、Ca2+反应生成沉淀和水,则不能共存,故C不选;
D.因Mg2+、OH-结合生成沉淀,则不能共存,故D不选;
故选B.
点评:本题考查离子的共存问题,熟悉复分解反应即可解答,注意常见离子的颜色来分析解答,题目难度不大.
本题难度:困难
2、选择题 0.1molMg分别在足量的O2、CO2、N2中燃烧,生成的固体质量依次为W1、W2、W3,则下列关系式中正确的是
A.W2>W1>W3
B.W1=W2>W3
C.W1=W2=W3
D.W3>W2>W1
参考答案:A
本题解析:分析:根据相同质量的Mg生成MgO和Mg3N2固体的质量增重大小,分析解答.
解答:根据关系式Mg~MgO可知,0.1molMg生成MgO,增重为:0.1mol×16g/mol=1.6g,
根据关系式3Mg~Mg3N2?可知,0.1molMg生成Mg3N2,增重为:0.1mol×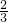 ×14g/mol=
×14g/mol=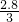 g≈0.93g.
g≈0.93g.
相同质量的Mg生成MgO比生成Mg3N2固体增重多,Mg与CO2反应,除生成等量的MgO,还有固体碳,所以W2>W1>W3.
故选A
点评:以镁的性质为载体考查学生计算能力,注意综合分析优化解题方法,易错点是镁与CO2反应易忽略生成的碳.
本题难度:简单
3、选择题 下列变化中,需要加入还原剂的是
A.2Cl-→Cl2
B.Fe2+→Fe3+
C.Cu2+→Cu
D.MnO4-→MnO2
参考答案:C
本题解析:分析:变化中某元素的化合价降低,在反应中被还原,则需要加入还原剂来实现转化.
解答:A、2Cl-→Cl2中,Cl元素的化合价升高,被氧化,则需要加入氧化剂来实现转化,故A不选;
B、Fe2+→Fe3+中,Fe元素的化合价升高,被氧化,则需要加入氧化剂来实现转化,故B不选;
C、Cu2+→Cu中,Cu元素的化合价降低,被还原,则需要加入还原剂来实现转化,如加入Fe,故C选;
D、MnO4-→MnO2中,Mn素的化合价降低,被还原,但可通过高锰酸钾分解来实现转化,则不需要加入还原剂,故D不选;
故选C.
点评:本题考查氧化还原反应,明确元素的化合价降低,在反应中被还原是解答本题的关键,D项是解答的难点和易错点.
本题难度:一般
4、选择题 将0.03mol?Cl2缓缓通入含有0.02mol?H2SO3和0.02mol?HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是
A.
B.
C.
D.
参考答案:D
本题解析:分析:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化.
解答:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4:
? Cl2 +H2SO3 +H2O=H2SO4 +2HCl,
?0.02mol?0.02mol?0.02mol? 0.04mol?
H2SO3是中强酸,H2SO4为强酸,溶液中的C(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化
Br-:
? Cl2 +2HBr=Br2 +2HCl,
? 0.01mol? 0.02mol?
HBr全部转变为HCl,C(H+)不变,故选:D.
点评:本题考查了氧化还原反应的计算,注意反应的先后顺序,难度不大.
本题难度:简单
5、选择题 下列物质中不含氯离子的是
①氯水?②氯化氢?③盐酸?④熔融氯化钠?⑤氯酸钾? ⑥氯化钾晶体?⑦四氯化碳.
A.①②⑤
B.②⑤⑦
C.⑤⑥⑦
D.①③④⑥
参考答案:B
本题解析:分析:氯酸钾中含有ClO3-,四氯化碳为非电解质,不能电离出氯离子,HCl为电解质,只有在溶液中才能电离出氯离子.
解答:①氯水中存在Cl2+H20?H++Cl-+HClO,含有氯离子,故①不选;
②HCl为电解质,只有在溶液中才能电离出氯离子,HCl不含氯离子,故②选;
③盐酸为HCl的水溶液,存在氯离子,故③不选;
④NaCl为电解质,在熔融状态下电离出氯离子,故④不选;
⑤氯酸钾中含有ClO3-,不含氯离子,故⑤选;
⑥氯化钾晶体为离子化合物,含有氯离子,故⑥不选;
⑦四氯化碳为非电解质,不能电离出氯离子,故⑦选.
故选B.
点评:本题考查物质的性质和组成等知识,题目难度不大,注意电解质和非电解质的判断以及离子化合物与共价化合物的区别.
本题难度:困难