微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 几种短周期元素的原子半径及主要化合价如下表(?)
元素代号
| L
| M
| X
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6,-2
| +2
| -2
|
下列叙述错误的是
A.R的氧化物对应的水化物可能具有两性? B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)>r(T2-)?D.最高价氧化物对应水化物碱性:L(OH)2>M(OH)3
参考答案:C
本题解析:L、M、X、R、T对应的元素分别为: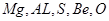 所以
所以
A正确,氢氧化铍具有两性;B正确,S单质燃烧不能生成三氧化硫;C错,离子半径大小关系为:r(T2-)>r(M3+);D正确;镁的金属性比铝强;
本题难度:一般
2、选择题 化学工作者从C2H6(g)+Cl2(g)→C2H5Cl(l)+HCl(g)受到启发,提出从农药和有机合成工业中可获得副产品盐酸.这一设想已成为现实,试指出从上述反应产物中获得盐酸的最佳分离方法
A.升华法
B.蒸馏法
C.水洗分液法
D.水洗萃取法
参考答案:C
本题解析:C2H5Cl(l)不溶于水,HCl(g)易溶于水形成盐酸.升华法、蒸馏法不能获得盐酸,水洗萃取法不是最佳方案.
本题难度:一般
3、填空题 (15分)C、Si、S和N元素在化学中占有极其重要的地位。
 (1)写出Si的基态原子价电子排布式 ?。
(1)写出Si的基态原子价电子排布式 ?。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ?。
 (4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
(4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
参考答案::(1) 3s23p2(2分)?O>C>Si (2分)
(2)? sp3(2分)?共价键(2分)
(3) Mg2+半径比Ca2+小,MgO晶格能大(3分)
(4) V字型(2分)? H2S(2分)
本题解析::电负性同周期从前往后增加,从上至下减小,O>C>Si SiC的晶体结构与晶体硅的相似,都是原子晶体,C原子的杂化方式为sp3,微粒间存在的作用力是?共价键。离子晶体的晶格能越大,离子键越强,晶格能与原子半径成反比,与电荷数成正比。MgO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大. SO2、NO2、H2S是分子晶体,分子结构为V字型。H2S有2对孤电子,和其他两种不一样。
本题难度:一般
4、选择题 某元素原子的核外有三个电子层,最外层有4个电子,该原子核内的质子数为(?)
A.14
B.15
C.16
D.17
参考答案:A
本题解析:元素原子的核外电子排布在最外层电子数确定的前提下,内层应该是满电子排布的,即第一层是2个电子,第二层是8个电子,最外层是4电子(已知),核外电子总数与原子核内质子数相等。故选A。
点评:本题考查元素原子的电子层排布规律的知识,题目难度不大。
本题难度:简单
5、选择题 有X、Y两种元素,原子序数≤20,X、Y原子的最外层电子数相同且离子半径X的小于Y的。(选项中m、n均为正整数)下列说法正确的是(?)
A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B.若Y(OH)n为强碱,则X (OH)n也一定为强碱
C.若HnYOm为强酸,则X是活泼非金属元素
D.若Y的最高正价为+m,则X的最高正价一定为+m
参考答案:C
本题解析:X、Y原子的最外层电子数相同,说明位于同一主族,离子半径X的小于Y的,则原子序数Y大于X,则:A中若HnXOm为硝酸,则X的氢化物为氨气,为碱性气体,溶于水呈碱性,故A错误;
B中如X、Y为金属元素,同主族元素从上到下元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,但X (OH)n不一定为强碱,故B不正确;
C中如X、Y为非金属元素,同主族元素从上到下元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,C正确;
D.若Y的最高正价为+m,X不一定有正价,如Cl的最高正价为+7价,而F的最高价为0价,故D错误,答案选C。
点评:该题是中等难度试题的考查,试题贴近高考,注重题答题的灵活性。本题需要注意同主族元素性质的递变规律,特别注意化合价等问题,有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般