微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 需加入适当的还原剂才能实现的反应是
A.PCl3 → PCl5
B.MnO2 → Mn2+
C.SO2 → SO3
D.Fe2O3→ Fe
参考答案:BD
本题解析:还原剂在化学反应中失去电子化合价升高,故只需看提供的反应物是否做氧化剂,若反应物做氧化剂,反应发生的过程中则需要还原剂。提供的选项中MnO2和Fe2O3做氧化剂,故MnO2→ Mn2+和Fe2O3→ Fe的反应中需要加入还原剂才能实现。
本题难度:简单
2、简答题 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是( )
A.1:2
B.2:1
C.1:3
D.3:1
参考答案:在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知作氧化剂的S原子与作还原剂的S原子的物质的量之比为2:1.
故选B.
本题解析:
本题难度:一般
3、简答题 在Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,反应中,
(1)______元素被氧化,______是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目______.
Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑
(3)若有3.2g的Cu参与反应,则被还原的H2SO4的质量为多少?______.
参考答案:(1)S元素化合价降低,被还原,Cu元素化合价升高,被氧化,则浓H2SO4为氧化剂,Cu为还原剂,故答案为:Cu;浓H2SO4;
(2)S元素化合价降低,由+6价降低到+4价,Cu盐酸化合价由0价升高到+2价,反应中Cu失电子,S得电子,该反应电子转移的方向和数目可表示为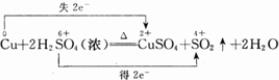 ,故答案为:
,故答案为: ;
;
(3)n(Cu)=3.2g64g/mol=0.05mol,1mol铜参加反应,则有1molH2SO4被氧化,则若有3.2g的Cu参与反应,被还原的硫酸的物质的量为0.05mol,
质量为0.05mol×98g/mol=4.9g,
故答案为:4.9g.
本题解析:
本题难度:一般
4、简答题 在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,若有3.2g的Cu参与反应,则被还原的H2SO4的物质的量是______mol.
参考答案:n(Cu)=3.2g64g/mol=0.05mol,
Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O? 被还原H2SO4
1mol? 1mol
0.05mol?n
n=0.05mol,
故答案为:0.05.
本题解析:
本题难度:一般
5、选择题 在2H2S+SO2→3S+2H2O的反应中,氧化剂和还原剂的物质的量比是( )
A.1:1
B.2:1
C.1:2
D.2:3
参考答案:反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;SO2中S元素化合价由+4价降低为0价,SO2是氧化剂.根据反应中化合价发生变化的S原子数目可知参加反应的H2S全部为还原剂,参加反应的SO2全部为还原剂,所以氧化剂与还原剂的物质的量之比等于化学计量数之比为1:2.
故选:C.
本题解析:
本题难度:一般