微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知2Fe2++Br2=2Fe3++2Br-,向10mL0.1mol?L-1?的FeBr2溶液中通入0.001mol?Cl2,反应后的溶液中,除含有Cl-外还一定( )
A.含Fe2+,不含Fe3+
B.含Fe3+,不含Br-
C.含Fe3+,含Br-
D.含Fe2+,含Fe3+
参考答案:C
本题解析:
本题难度:一般
2、选择题 在离子反应3Cu+yH++xNO3-=3Cu2++2NO+qH2O中,系数q的值为
A.1
B.4
C.3
D.2
参考答案:B
本题解析:分析:在离子反应方程式中,各元素遵循原子守恒,且方程式遵循电荷守恒,所以根据原子守恒和电荷守恒来解答.
解答:根据N原子守恒知,x=2,根据电荷守恒得:y-2=3×2,y=8,根据氢原子守恒得,8=2q,所以q=4,故选B.
点评:本题考查氧化还原反应配平,明确守恒思想是解本题关键,难度不大.
本题难度:困难
3、简答题 在氨的催化氧化反应4NH3+5O2
4NO+6H2O中,氧化剂是______.(填化学式);若反应中转移10mol电子,则消耗NH3的物质的量是______mol.
参考答案:反应4NH3+5O2催化剂.△4NO+6H2O中,N元素化合价升高,O元素化合价降低,则O2为氧化剂,NH3为还原剂,
反应中N元素的化合价由-3价升高到+2价,若反应中转移10mol电子,则应有2mol氨气参加反应,
故答案为:O2;2.
本题解析:
本题难度:一般
4、选择题 将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体.再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀.根据题意推断气体x的成分可能是
A.0.3mol?NO2?和0.3mol?NO
B.0.2mol?NO2和0.1mol?N2O4
C.0.1mol?NO、0.2mol?NO2和0.05mol?N2O4
D.0.6mol?NO
参考答案:C
本题解析:分析:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为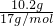 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
解答:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为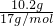 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
A、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故A错误;
B、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,
故B错误;
C、生成0.1mol NO、0.2mol NO2和0.05mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.05mol×2×(5-4)=0.6mol,得失电子相等,故C正确;
D、生成0.6molNO,N元素获得电子为0.6mol×(5-2)=1.8mol,故D错误.
故选:C.
点评:考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.
本题难度:一般
5、填空题 下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说明.
| 配料 | 氯化钠、碘酸钾
含碘量
20~30mg/1Kg
保质期
18个月
食用方法
勿长时间炖炒
贮藏指南
避热、避光、密封、防潮
|
试回答下列问题:
(1)由食用方法和贮藏指南可推测,碘酸钾的化学性质之一是______.
(2)制造含碘食盐不直接用碘单质而用碘酸钾,主要原因可能是______(填序号)
A、碘酸钾价格低,有利于减轻居民食用加碘盐的经济负担
B、碘酸钾易溶解于水中,有利于加碘盐的生产操作和食用吸收
C、碘酸钾热稳定性优于碘,有利于加碘盐生产、贮藏和使用过程中减少碘的损失
(3)实验室可用酸化的KI溶液和淀粉检验碘酸钾的存在,反应的方程式为:
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O,其实验的现象是______.反应中当有1mol还原剂被氧化时,则有______mol氧化剂被还原,有约______个电子发生了转移.
(4)用单质碘与氯酸钾发生置换反应可以制得碘酸钾,该反应的化学方程式为______,从以上反应能否得出I2的氧化性比Cl2强的结论?______(填“能”或“不能”)试说明原因______.
参考答案:(1)根据“文字说明”避光、避热,可推测碘酸钾的一种化学性质为:见光、受热易分解,故答案为:见光、受热易分解;
(2)碘易升华,且不易溶于水,不利用碘元素的吸收,而碘酸钾易溶解于水中,有利于加碘盐的生产操作和食用吸收,故答案为:B;
(3)5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O反应生成碘单质,遇淀粉变蓝,观察到溶液变蓝色,KI中的I元素化合价升高,KIO3中I元素化合价降低,则1mol还原剂被氧化时,由反应可知消耗0.2mol氧化剂,转移1mol×(1-0)=1mol电子,约6.02×1023个,
故答案为:溶液变蓝色;0.2;6.02×1023;
(4)碘与氯酸钾发生置换反应可以制得碘酸钾和氯气,该反应为I2+2KClO3=Cl2+2KIO3,I元素的化合价升高,不能比较单质的氧化性,因为此反应中,碘是还原剂,氯气是还原产物,只能推断出碘的还原性比氯气强,
故答案为:I2+2KClO3=Cl2+2KIO3;不能;因为此反应中,碘是还原剂,氯气是还原产物,只能推断出碘的还原性比氯气强.
本题解析:
本题难度:一般