微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A原子在核外第三层上有3个电子,B原子在核外第二层上有6个电子,它们组成稳定化合物的化学式是( )
A.A2B
B.AB
C.A3B2
D.A2B3
参考答案:A原子在核外第三层上有3个电子,应为Al,B原子在核外第二层上有6个电子,应为O,具有较强的非金属性,
二者形成的化合物为Al2O3,
故选D.
本题解析:
本题难度:一般
2、选择题 酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )
A.R原子的电子层数比N原子的电子层数多1
B.R的最高化合价与N的最高化合价相等
C.RO3-和NO3-只能被还原,不能被氧化
D.R和N为同族元素
参考答案:A.RO3-和NO3-所带电荷数一样,又因为酸根RO3-所含电子数比硝酸NO3-的电子数多10,所以R和N不是同一族,R为Cl,故A正确.
B.R为Cl,最高价为+7,N的最高化合价为+5,故B错误.
C.+5ClO?-3既能被还原,又能被氧化,故C错误.
D.R为Cl,与N不是同族元素,故D错误.
故选A
本题解析:
本题难度:一般
3、选择题 某氮氧化合物的一分子中含有38个电子。试问该氮氧化合物是下列的哪一选项
[? ]
A.NO
B.NO3
C.N2O
D.N2O3
E.N2O5
参考答案:D
本题解析:
本题难度:简单
4、简答题 A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为______
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式______.
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为______;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)______.
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是______.
(5)已知:2CD2(g)?
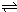
?C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
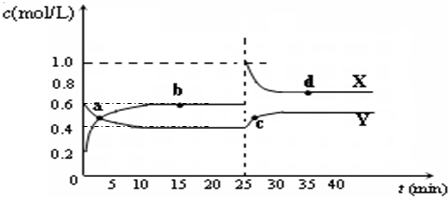
①a、b、c、d四个点中,化学反应处于平衡状态的是______点.
②25min时,增加了______(填物质的化学式)______mol.
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是______(填字母).
参考答案:A、B、C、D、E、F均为短周期元素,其原子序数依次增大.B的最外层电子数是次外层电子数的两倍,则B有2个电子层,最外层有4个电子,则B为碳元素;A的最外层电子数等于其电子层数,原子序数小于碳元素,则A为氢元素;D是地壳中含量最高的元素,则D为氧元素;C元素介于氧元素与碳元素之间,则C为氮元素;D和F同主族,则F为硫元素;A和E同主族,E是所有短周期主族元素中原子半径最大的元素,则E为钠元素.
(1)B与D形成化合物BD2为CO2,CO2中碳原子与氧原子之间形成2对共用电子对,结构式为O═C═O.
故答案为:O═C═O.
(2)A、C、D三元素能形成一种强酸甲,甲为HNO3,单质B为碳单质,碳与浓硝酸反应的方程式为
C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O.
故答案为:C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O.
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,则该两种盐为NaHSO4、NaHSO3,二者反应的离子方程式为H++HSO3-═SO2↑+H2O,由B、D、E组成的盐为?Na2CO3,碳酸钠是强碱弱酸盐,碳酸根水解
?CO32-+H2O

HCO3-+OH-,使溶液呈碱性.
故答案为:H++HSO3-═SO2↑+H2O;?CO32-+H2O

HCO3-+OH-.
(4)C2A4是N2H4,N2H4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.原电池正极发生还原反应,氧气在正极放电,正极的电极反应式是O2+2H2O+4e-═4OH-.
故答案为:O2+2H2O+4e-═4OH-.
(5)发生反应2NO2(g)?
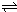
?N2O4(g);△H<0.由图可知平衡时,X为生成物,X的浓度变化为0.4mol/L,Y为反应物,Y的浓度变化为0.2mol/L,所以X为NO2,Y为N2O4.
①浓度不变时处于平衡状态,由图可知,bd处于平衡状态.
故答案为:bd.
②由图可知平衡时,X为生成物,X的浓度变化为0.4mol/L,Y为反应物,Y的浓度变化为0.2mol/L,所以X为NO2,Y为N2O4.25min时,X的浓度瞬间增大,X的浓度增大为0.4mol/L,Y的浓度瞬间不变,所以应该增加了NO2,增加二氧化氮的物质的量为0.4mol/L×2L=0.8mol.
故答案为:NO2;?0.8.
③二氧化氮的浓度越大,气体颜色越深,所以a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是 cdba.
故答案为:cdba.
本题解析:
本题难度:一般
5、选择题 X、Y、Z、W四种短周期元素的最外层电子数之和为20.在周期表中X与Y、Z、W紧密相邻,X、Y两元素的原子序数之和等于Z元素的原子序数.下列说法正确的是( )
A.原子序数:Z>Y>X>W
B.X、Y、Z、W形成的单质最多有6种
C.X元素最高价氧化物对应水化物的化学式为:H3XO4
D.四种元素的气态氢化物中,W的气态氢化物最稳定
参考答案:A、W是C元素,X是N元素,Y是O元素,Z是P元素,所以原子序数Z>Y>X>W,故A正确.
B、碳元素形成的单质有金刚石、石墨、C60等,氮元素形成的单质有氮气,氧元素形成的单质有氧气和臭氧,磷元素形成的单质有红磷和白磷,故B错误.
C、X是N元素,X元素最高价氧化物对应水化物是硝酸,其化学式为:HNO3,故C错误.
D、非金属性越强的非金属元素其气态氢化物越稳定,这四种元素中非金属性最强的是O元素,所以氢化物最稳定的是Y,故D错误.
故选A.
本题解析:
本题难度:一般