微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色
B.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
C.能使品红溶液褪色的不一定是SO2
D.SO2和Cl2都能漂白,若将两种气体同时通入,漂白效果会更好
参考答案:A.二氧化硫与溴水、KMnO4溶液均发生氧化还原反应,则体现其还原性,只有使品红褪色体现其漂白性,故A错误;
B.二氧化硫与有色物质化合生成无色物质,活性炭具有吸附性,漂白粉、Na2O2都具有强氧化性,使红墨水褪色,漂白原理不同,故B错误;
C.SO2、漂白粉、活性炭、Na2O2都能使品红溶液褪色,则能使品红溶液褪色的不一定是SO2,故C正确;
D.两种气体同时通入生成硫酸和盐酸,均不具有漂白性,漂白效果减弱,故D错误;
故选C.
本题解析:
本题难度:一般
2、填空题 含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式:__________________。
(2)Ba2+有剧毒。我市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将有毒化工原料碳酸钡当作干粉使用,导致多人中毒。试用化学方程式说明“毒烧饼”事件中的中毒原因__________________。患者被送往医院后,医生往往让其服用__________________(填题干所列7种物质中的一种)来解毒。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面__________________,则发生了钝化;若铁棒表面__________________,则未发生反应。
(4)美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,其原理为(用化学方程式表示):__________________。
(5)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式:__________________。
(6)制取硫酸铜的方法有两种:
方法一:2Cu+O2==2CuO,CuO+ H2SO4=CuSO4+H2O,
方法二:Cu+2H2SO4(浓) == CuSO4+SO2↑+2H2O,
方法一与方法二相比,其优点(两点)是:___________________、_________________。
参考答案:(1)2H2SO3+O2=2H2SO4
(2)BaCO3+2HCl=BaCl2+CO2↑+H2O;Na2SO4
(3)无明显现象(无现象也可);有紫红色物质析出
(4)Na2SO3+SO2+H2O==2NaHSO3
(5)SO2+2CO S+2CO2
S+2CO2
(6)节省原料(硫酸用量少);无污染
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
参考答案:A.CO2和SO2对应的酸比HCl弱,二者与BaCl2不反应,没有沉淀产生,故A错误;
B.铜和稀硫酸不反应,加入Cu(NO3)2固体,NO3-具有强氧化性,在酸性条件下与Cu发生氧化还原反应,可溶解铜,故B错误;
C.氨水呈弱碱性,向AlCl3溶液中滴加氨水,生成Al(OH)3,Al(OH)3不溶于弱碱,但可溶于强碱和强酸,则再加入过量NaHSO4溶液,沉淀消失,故C正确;
D.加入少量CuSO4固体,置换出铜,锌和铜在酸性条件下形成原电池反应,反应速率较大,故D错误.
故选C.
本题解析:
本题难度:简单
4、填空题 分析下图装置,回答问题:
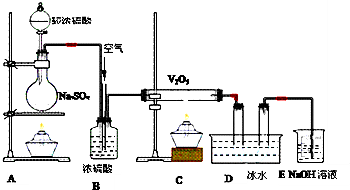
(1)装置A的烧瓶中发生的反应的化学方程式为______,
(2)装置C的直玻管中发生的反应的化学方程式为______,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是______,
(4)装置E中NaOH的作用是______,反应的离子方程式为______;
(5)B装置的作用很多,除了可以混匀气体外,还可以:______;______.
参考答案:(1)因强酸可以制备弱酸,H2SO4是强酸,H2SO3是弱酸,发生的反应为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;?
(2)因二氧化硫在五氧化二钒的作用下,发生催化氧化:2SO2+O2催化剂.△2SO3,故答案为:2SO2+O2催化剂.△2SO3;
(3)因三氧化硫的熔点、沸点低,经冷凝后变为固体,而二氧化硫的熔点、沸点较高,常温下为气体,故答案为:SO3;
(4)因二氧化硫有毒,需要进行尾气吸收,以防止污染空气,由于二氧化硫为酸性氧化物,可以与碱反应:
2NaOH+SO2=Na2SO3+H2O,离子方程式:SO2+2OH-=SO32-+2H2O,故答案为:吸收尾气;SO2+2OH-=SO32-+2H2O;
(5)因浓硫酸具有吸水性,可做干燥剂,单位时间内产生气泡数越多,气体的体积越大,故答案为:与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1);干燥气体.
本题解析:
本题难度:简单
5、填空题 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).
8Cu+4FeO+2Fe2O3+16SO2 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是________(填代号).
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-===2SO42-+I2 通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO. 提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________.
参考答案:(1)Cu、O
(2)b、c
(3)2Fe3++2I-===2Fe2++I2;S2O82-+2Fe2+===2SO42-+2Fe3+
(4)a.Al3++4OH-===AlO2-+2H2O;
b.稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
本题解析:
本题难度:一般