微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.放热反应一定能自发进行
B.二氧化硫能使品红溶液、溴水褪色,分别说明二氧化硫具漂白性、还原性
C.将AlCl3溶液和NaAlO2溶液分别蒸干和灼烧,所得产物的成分均为Al2O3
D.工业上能通过BaSO4(s)+Na2CO3(aq)?BaCO3(s)+Na2SO4(aq)反应先制得BaCO3,再由BaCO3进一步制取可溶性钡盐,是因为Ksp(BaSO4)>Ksp(BaCO3)
参考答案:A、放热反应△H<0,△S>0高温下不能自发进行,故A错误;
B、二氧化硫具有漂白作用,能使品红试液褪色,二氧化硫和溴单质发生的是氧化还原反应,溴单质氧化二氧化硫生成硫酸,表现二氧化硫的还原性,故B正确;
C、氯化铝水解生成氢氧化铝和盐酸,加热氯化氢挥发,平衡正向进行,得到水解产物氢氧化铝.灼烧得到氧化铝,偏铝酸钠溶液水解生成氢氧化铝和氢氧化钠,加热蒸发得到偏铝酸钠,灼烧不能得到氧化铝,故C错误;
D、BaSO4(s)+Na2CO3(aq)?BaCO3(s)+Na2SO4(aq)反应先制得BaCO3,利用的是沉淀转化的原理应用,当饱和溶液中离子浓度的幂次方乘积≥Ksp时,会先沉淀,反应与离子浓度有关,实质Ksp(BaSO4)>Ksp(BaCO3),故D错误;
故选B.
本题解析:
本题难度:一般
2、简答题 某同学用如图所示装置探究SO2的性质及其有关实验.
(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的离子方程式______
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:①少量SO2通入紫色石蕊试液,现象是______,继续通入过量SO2气体,现象是______.
②SO2通入紫色KMnO4溶液,现象是______,其反应的离子方程式为______.
③过量SO2慢慢地通入澄清石灰水中,现象______离子方程式是______
④若C为双氧水,则通入SO2后,所得溶液 www.91exAm.org是______?(填溶质的化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有______.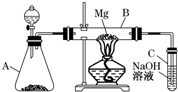
参考答案:答案:(1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,离子方程式为:SO32-+2H+═SO2↑+H2O.
故答案为:SO32-+2H+═SO2↑+H2O.
(2)①二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性,紫色石蕊试液遇酸变红色,所以溶液会变红;二氧化硫有漂白性,但不能使石蕊褪色,所以继续通入过量SO2气体,现象是不褪色或不明显.
故答案为:变红;不褪色或不明显.
②二氧化硫有还原性,高锰酸钾有强氧化性,所以二氧化硫和高锰酸钾能发生氧化还原反应而使高锰酸钾溶液颜色逐渐变浅或紫色消失,离子反应方程式为:5SO2+2MnO4+2H2O═5SO42-+2Mn2++4H+.
故答案为:颜色逐渐变淡或紫色消失;5SO2+2MnO4+2H2O═5SO42-+2Mn2++4H+.
③二氧化硫和氢氧化钙反应生成不溶于水的亚硫酸钙和水,亚硫酸钙和二氧化硫、水能反应生成可溶性的亚硫酸氢钙,离子反应方程式为:Ca2++2OH-+SO2=CaSO3 ↓+H2O;CaSO3+SO2+H20=Ca2++2HSO3-.
故答案为:先变浑浊,后又变澄清;Ca2++2OH-+SO2=CaSO3 ↓+H2O;CaSO3+SO2+H20=Ca2++2HSO3-.
④二氧化硫有还原性,双氧水有强氧化性,所以二氧化硫和双氧水能发生氧化还原反应生成硫酸;碳酸盐和碳酸氢盐能与硫酸反应生成二氧化碳,若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有碳酸盐或碳酸氢盐.
故答案为:H2SO4;碳酸盐或碳酸氢盐.
本题解析:
本题难度:一般
3、选择题 某学生课外活动小组利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液颜色变为红色,冷却后恢复无色,则( )
A.溶有SO2的品红溶液
B.溶有NH3的酚酞溶液
C.溶有SO2的酚酞溶液
D.溶有Cl2的品红溶液