微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:
A.在250mL的容量瓶中配制250mL烧碱溶液
B.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中滴加几滴酚酞做指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为C的标准盐酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL
E.在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,且颜色不再变化,记下读数V2mL
回答下列问题:
(1)正确操作步骤的顺序是(填字母):??→?→??→ D →?。
(2)操作E中的锥形瓶下垫一张白纸的作用是?。
(3)操作D中液面应调整到?,尖嘴部分应?。
(4)某学生实验时把锥形瓶用烧碱溶液润洗,使测定的浓度?(填“偏高”、“偏低”或“无影响”),原因是?。?
(5)当用酸滴定碱时,下列操作中使测定结果(碱的浓度)偏低的是?。
A.酸式滴定管滴至终点时,俯视读数?
B.碱液移入锥形瓶后,加了10 ml蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用操作液润洗
D.酸式滴定管注入酸液后,尖嘴留有气泡,开始滴定
(6)该烧碱样品纯度的计算式为?。?
参考答案:(1)C、A、B、E;?(2)便于观察溶液颜色的变化。
(3)“0”或“0”以下某一刻度;充满溶液,无气泡;
(4)偏高;该错误操作将导致多消耗标准酸溶液;
(5)A
(6)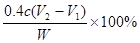
本题解析:(1)考查中和滴定实验操作。
(2)白纸能使溶液颜色的变化更清晰,便于观察溶液颜色的变化。
(3)滴定管的刻度是自上而下逐渐增大的,所以液面应该调节到“0”或“0”以下某一刻度。滴定管的尖嘴部分应该是充满溶液,无气泡。
(4)锥形瓶用烧碱溶液润洗,则锥形瓶内碱的物质的量增加,消耗酸的体积增大,测定结果偏高。
(5)俯视读数,则读数偏小,即酸的体积偏小,测定结果偏低。将碱液稀释,并没有改变OH-的物质的量,所以测定结果不变。没有用标准液润洗,则相当于稀释了酸,因此消耗酸的将偏大,测定结果偏高。尖嘴留有气泡,则说明起始读数偏小,因此测定结果偏高,答案选A。
(6)消耗酸的体积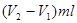 ,所以原样品中氢氧化钠的质量是
,所以原样品中氢氧化钠的质量是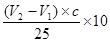 ,所以烧碱样品纯度的计算式为
,所以烧碱样品纯度的计算式为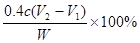 。
。
本题难度:一般
2、实验题 (16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
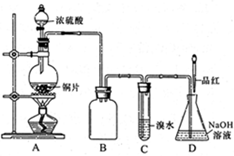
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定? b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值? d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完;? II. 漂白粉不足;? III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号
| 实验操作
| 现象
| 反应的可能情况
|
①
| 滴加少量淀粉碘化钾溶液,振荡
| ?
| III
|
②
| 滴加少量棕红色的KI3溶液,振荡
| ?
| II
|
③
| 滴入加少量酸性KMNO4溶液,振荡
| 溶液呈紫色
| ?
|
④
| 加入几小块CaCO3固体
| 有气泡产生
| ?
参考答案:(共16分)
(1)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(2分)?
防止C中液体倒吸入A中(或防倒吸,或安全瓶)(2分)
(2)还原(2分)?溶液红色褪去(2分)?
(3)b c(2分)
(4)①溶液变为蓝色(1分)? ②溶液褪色(1分)
③Ⅰ或Ⅲ(2分)? ④Ⅰ或Ⅱ(2分)
本题解析:(1)Cu与浓硫酸加热生成CuSO4、SO2和H2O,化学方程式为:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O;因为SO2易溶于水,而且SO2能与溴水反应,容易产生倒吸,所以装置B的作用是:防止C中液体倒吸入A中。
(2)装置C中盛有溴水,具有较强的氧化性,设计装置C的目的是验证SO2的还原性;若NaOH全部转化为NaHSO3,不能与SO2反应,通入的SO2具有漂白性,能使品红褪色,所以D中NaOH全部转化为NaHSO3的标志是:溶液红色褪去。
(3)反应后的溶液含有CuSO4,由于溶液中有铜离子使溶液呈蓝色,不能指示反应的终点,所以不能用酸碱中和滴定法测定剩余酸的物质的量的浓度;CuSO4能与BaCl2反应生成BaSO4沉淀,所以不能用与足量BaCl2溶液反应,称量生成沉淀的质量的方法测剩余H2SO4的量;根据与足量Zn反应,测量生成H2的体积、用PH计测溶液PH值可以求出剩余H2SO4的量,故bc正确。
(4)①漂白粉过量,过量的漂白粉把KI氧化为I2,使淀粉溶液变蓝。
②漂白粉不足,剩余NaHSO3,棕红色的KI3溶液氧化NaHSO3,生成无色的KI,所以现象为:溶液褪色。
③滴入加少量酸性KMNO4溶液,振荡,溶液呈紫色,说明NaHSO3已完全反应,可能为I. HSO3-与ClO-刚好反应完或III. 漂白粉过量。
④若HSO3-与ClO-刚好反应完,可生成HCl,能与CaCO3反应生成气泡;NaHSO3呈酸性,能与CaCO3反应生成CO2,所以I. HSO3-与ClO-刚好反应完、II. 漂白粉不足能与CaCO3反应生成气泡。
本题难度:一般
3、实验题 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
【实验一】从镁铝合金片上剪下一小块,先称重,然后投到盛有10 mL 10 mol·L-1 NaOH溶液(足量)的锥形瓶里。实验测得不同时刻气体体积如下图:?

(1) t0~t1过程中速率比t1~t2速率____(填“快”或“慢”),其主要原因是___。
(2)影响过程t1~t2速率的主要原因是:①___, ②___。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①将另一种不同方法所需数据填入下表。

【实验二】向实验一的锥形瓶里滴加1 mol.L-1 HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:____。
【实验三】取实验二的锥形瓶里的溶液10 mL,向其中滴加a mLc1mol.L-1 NaOH之后,改成滴加 c2mol.L-1HCl,所得沉淀y(mol)与试剂总体积 V(mL)间的关系如下图所示。据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的 NaOH溶液体积的两倍,则c1/c2=____,
(2)所加入NaOH溶液的体积a=____mL。
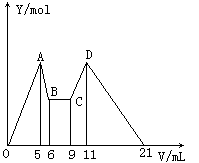
参考答案:【实验一】(1)慢 ;合金表面有氧化膜
(2)①形成原电池;②反应放热,温度升高
(3)②“测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” 【实验二】AlO2-+4H+=Al3+ +2H2O
【实验三】(1)2或2:1;
(2)7
本题解析:
本题难度:一般
4、实验题 设计一个实验,能通过观察到明显的现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位学生装设计了如图所示五个装置,试回答:
(A)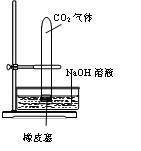 ?(B) ?(B)
(C)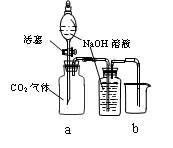 (D) (D)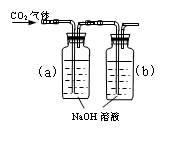
(E)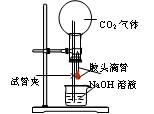
⑴对图A-E,请指出能达到实验目的的装置_______(用A、B、C、D、E填空),并说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
装置
| 实验方法
| 实验现象
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
⑵能否设计出其它一些方法来证明CO2与NaOH溶液发生了反应。
参考答案:⑴
装置
实验方法
实验现象
A
将分液漏斗中的NaOH溶液滴入烧瓶
看到水槽中的水被吸入到烧瓶中
B
将充满CO2的试管的橡皮塞打开
水槽中的NaOH溶液上升到试管中
C
通过分液漏斗向充满CO2气体的集气瓶a中加入NaOH溶液
b中NaOH溶液不能排入烧杯中
D
向a瓶中通入CO2气体
B中无气泡冒出
E
将滴管中的NaOH溶液挤入烧瓶
产生喷泉现象
本题解析:⑴从CO2与NaOH溶液发生了反应后,CO2的减少导致压强的减小或气泡的减少角度思考,都能达到实验的要求。反应的操作及实验现象如下:
装置
实验方法
实验现象
A
将分液漏斗中的NaOH溶液滴入烧瓶
看到水槽中的水被吸入到烧瓶中
B
将充满CO2的试管的橡皮塞打开
水槽中的NaOH溶液上升到试管中
C
通过分液漏斗向充满CO2气体的集气瓶a中加入NaOH溶液
b中NaOH溶液不能排入烧杯中
D
向a瓶中通入CO2气体
B中无气泡冒出
E
将滴管中的NaOH溶液挤入烧瓶
产生喷泉现象
⑵可以从CO2和NaOH溶液发生反应生成的产物角度分析考虑,得到如下方法(其它合理的想法也可以):A:将反应后所得的溶液适当加热后无大量气泡冒出,测定NaOH溶液反应前后的pH减小,说明是酸性氧化物CO2作用于强碱性物质NaOH。B:在反应后的产物中加入盐酸,产生无色无味、能是澄清石灰水变浑浊的气体,为CO2。C:在BaCl2溶液中分别加入NaOH溶液和通入CO2无明显现象,但若既加入NaOH溶液,又通入CO2,则有白色沉淀生成,意味NaOH溶液和CO2发生了反应D:对照实验:在等量的已通入较多的CO2的NaOH溶液和未通入CO2的NaOH溶液中加入铝片,观察生成气泡的速率。
本题难度:一般
5、实验题 某课外小组同学对不同条件下铁钉的锈蚀进行了实验,并于一周后观察。

(1)铁钉被腐蚀程度最大的是____(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)根据上述实验,你认为铁发生电化学腐蚀的条件是____。 实验④中正极的电极反应式为________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防止金属被腐蚀可 采取的措施是____(至少写两种)。
参考答案:(1)④
(2)电化学腐蚀
(3)铁与电解质溶液接触、与潮湿空气接触; O2+2H2O+4e-==4OH-
(4)定期涂防锈漆;改变金属内部结构制成不锈钢、其他合金;保持环境的干燥等
本题解析:
本题难度:一般
|