微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是(?)
A.单质跟卤化物之间的置换情况
B.跟银结合而形成的卤化银的颜色变化情况
C.跟氢气反应的情况
D.跟水反应的情况
参考答案:B
本题解析:单质的氧化性强弱,即为单质的得电子能力;可以卤素之间的置换,跟氢气反应的难易,跟水反应的情况来判断,不能从物理性质如:颜色、状态、密度、溶解度等来判断,也不能从其化合物的颜色来判断。
本题难度:简单
2、填空题 (10分)洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为?;
(2)实验室常用软锰矿(主要成分为MnO2) 和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)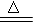 ?MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是?(填化学式),氧化剂与还原剂的物质的量之比为??,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子??mol?。
?MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是?(填化学式),氧化剂与还原剂的物质的量之比为??,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子??mol?。
(3)检验Cl2已集满的方法:??。
参考答案:(10分).(1) 2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 + 2H2O
(2) Cl2 ??1︰2 ??0.06 ?
(3)将湿润的淀粉KI试纸置于集气瓶口,若变蓝则已集满(其他合理答案也可)
本题解析:略
本题难度:简单
3、简答题 (18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。

仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl2与FeBr2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol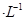 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl2先将Fe2+氧化生成Fe3+,溶液逐渐变黄色,Cl2再把Br-氧化成Br2,溶液变为棕黄色。
假设2:Cl2先将Br-氧化生成Br2,溶液逐渐变黄色,Cl2再把Fe2+氧化成Fe3+,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl2、Fe3+、Br2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,写出反应的离子方程式:________ 。
参考答案:(18分)
(1)分液漏斗(1分)?饱和食盐水(2分)除去尾气中的氯气防止污染空气(2分)
MnO2+4H++2Cl? Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)①取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。(3分)或取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。(3分)
②取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置(2分) Cl2 > Br2 >Fe3+(2分)
假设1(1分)
(3)2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?(3分)
本题解析:(1)根据实验装置图,仪器A的名称为分液漏斗;MnO2与浓盐酸反应制取的氯气中含有HCl和水分,所以装置C中的试剂是饱和食盐水,作用是吸收HCl杂质;氯气有毒,不能排放到大气中,所以装置F的作用是:除去尾气中的氯气防止污染空气;MnO2与浓盐酸反应生成MnCl2、Cl2、H2O,离子方程式为:MnO2+4H++2Cl? Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)①根据假设①设计实验方案,应检验溶液中是否含有Fe3+,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。根据假设②设计实验方案,应检验溶液中是否含有Br2,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。
②实验现象为:CCl4层由无色变为橙色,说明生成了Br2,应加入Cl2,所以实验操作为:取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置;根据氧化剂的氧化性大于氧化产物的氧化性可得氧化性由强到弱的顺序为:Cl2 > Br2 >Fe3+;还原性由强到弱的顺序为:Fe2+ > Br? > Cl?,所以Cl2先氧化还原性强的Fe2+,故假设①合理。
(3)向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,Cl2先氧化0.1mol Fe2+,消耗Cl2 0.05mol,剩余的0.05mol Cl2再氧化0.1mol Br?,所以离子方程式为:2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?
本题难度:一般
4、选择题 下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是(? )
A.将NaHCO3固体加入新制氯水中,有无色气泡产生(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
参考答案:B
本题解析:氯水中存在H+,与NaHCO3反应产生CO2;氯水使红色布条褪色是因为氯水中存在HClO,而不是因为氯水中存在HCl;氯水中存在的Cl2能氧化Fe2+―→Fe3+,故滴加KSCN溶液,溶液呈红色;氯水中存在的Cl-能与AgNO3溶液生成白色沉淀。
本题难度:简单
5、填空题 (6分) 氯元素有多种化合价,下列是按氯元素化合价由低到高排列的多种物质:NaCl、?、HClO、Ca(ClO)2、KClO3。请根据题意选择合适的化学式填空:
(1)根据氯元素的化合价变化,横线上应该填的物质为?;
(2)上述含氯化合物中,其固体能用于实验室制备氧气的是?;
(3)上述含氯化合物中,其水溶液有弱酸性和漂白性的是?。
参考答案:
(1)Cl2?(2)KClO3
(3)HClO
本题解 析:略
本题难度:简单