微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
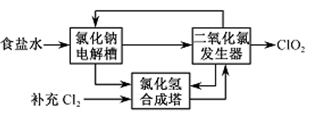
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□?(D)?+24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
参考答案:
(1)①BaCl2
BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s)(或其它合理答案)
②H2、Cl2
2NaClO3 + 4HCl  ?2ClO2↑ + Cl2↑ + 2NaCl + 2H2O
?2ClO2↑ + Cl2↑ + 2NaCl + 2H2O
(2)1C6H12O6+ 24 NaClO3 + 12H2SO4 24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4
24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4
(3)2.5
本题解析:
(1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去。根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+ CO32- (aq)= BaCO3(s)+SO42- (aq)。②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl。根据流程图可知加入物质为NaClO3和HCl,生成ClO2;可以写出方程式,并用化合价升降法配平得到。
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2。Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到。
(3)每摩尔Cl2得到2mol电子,而没摩尔ClO2得到5mol电子,故为2.5倍。
【考点定位】考查化学工艺流程,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识。
本题难度:一般
2、选择题 向含NaBr、KI的溶液里通入过量的氯气,然后将溶液蒸干并灼烧,最终留下的物质是(?)
A.NaCl和KBr
B.KCl和NaBr
C.KCl和NaCl
D.NaCl、KCl和I2
参考答案:C
本题解析:I2易升华,过量Cl2反应后灼烧,留下的一定是金属氯化物。
本题难度:一般
3、选择题 三氯化氮分子中每个原子的最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向氮原子。则下列关于三氯化氮的叙述正确的是(? )
A.NCl3为非极性分子
B.NCl3跟水反应的产物为NH3和HClO
C.NCl3跟水反应生成NH4Cl、O2和Cl2
D.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
参考答案:B
本题解析:因氮与氯的共用电子对偏向氮原子,则在NCl3中,N显-3价,Cl显+1价,则其发生水解的方程式应为:NCl3+3H2O====NH3+3HClO。又因氨气分子的空间构型推知NCl3为三角锥形结构,为极性分子。
本题难度:简单
4、选择题 用含4 mol HCl的浓盐酸与足量的MnO2共热,生成的氯气为(?)
A.2 mol
B.1 mol
C.小于1 mol
D.小于2 mol,大于1 mol
参考答案:C
本题解析:4HCl(浓)+MnO2====MnCl2+Cl2↑+H2O
4 mol? 1 mol
随着反应的进行,浓盐酸的浓度变稀,反应停止,所以生成Cl2小于1 mol。
本题难度:简单
5、选择题 生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己.如果发生了氯气(能与碱性溶液反应)泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,逆风撤离
D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
参考答案:A、虽然氯气能和水反应,且氯气的溶解性不大,室内放一盆水不能吸收大量的氯气,故A错误;
B、氯气的密度定义空气的密度,且氯气有毒,故B错误;
C、根据风向,向逆风方向撤离,故C正确;
D、Cl2+H2O=HCl+HClO、2HCl+Na2CO3=2NaCl+H2O+CO2↑,所以可用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离,故D正确;
故选CD.
本题解析:
本题难度:一般