微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
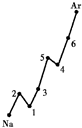
1、简答题 第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从图分析可知,同一主族元素原子的第一电离能I1变化规律是______;
(3)图中5号元素在周期表中的位置是______;
(4)图中4、5、6三种元素的电负性大小顺序为______.
参考答案:(1)Na--Ar之间六种元素原子序数增加,用短线连接起如下图:
;
故答案为:(1)

;
(2)同一主族元素原子的第一电离能I1,如上图以第ⅠA族为例,变化规律从上到下依次减小,其他族一致;
故答案为:从上到下依次减小;
(3)5号元素为15号元素氮,在周期表中的位置为第三周期,第ⅤA族;
故答案为:第三周期,ⅤA族;
(4)同周期元素的电负性为从左到右,电负性逐渐增大,即电负性为6>5>4;
故答案为:6>5>4.
本题解析:
本题难度:一般
2、选择题 下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是
[? ]
A.同周期元素的原子半径随着核电荷数的增大而增大
B.同主族元素的原子半径随着核电荷数的增大而增大
C.同周期元素的第一电离能随着核电荷数的增大而增大
D.同主族元素的第一电离能随着核电荷数的增大而增大
参考答案:BC
本题解析:
本题难度:一般
3、选择题 某元素的第一电离能至第七电离能(kJ/mol)如下

该元素最有可能位于元素周期表的族是
[? ]
A.ⅠA
B.ⅡA
C.ⅢA
D.ⅣA
参考答案:C
本题解析:
本题难度:一般
4、填空题 Al和Si,Ge和As在周期表处于金属元素和非金属元素的过渡区域,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)写出As在周期表中的位置_____________,其价电子的电子排布式为____________________?;
(2)Ge与As,哪种元素的第一电离能大?________原因是______________________;
(3)AlCl3是化工生产中常用的催化剂,熔点为192.6℃,熔融状态是通过配位键形成二聚体Al2Cl6 ,请画出Al2Cl6结构图示______________________;
(4)超高导热绝缘材料纳密氮化铝(AlN)在绝缘材料中应用广泛,其晶体结构与金刚石类似。则每个Al原子与______个N原子相连,与同一个Al原子相连的N原子构成的空间构型为________。氮化铝(AlN)与金刚砂(SiN)相比,晶体溶沸点较高的是____________,原因是____________________________。
(5)液态SiCl4常用作烟雾剂,原因是Si的3d空轨道能与水配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其发烟原理________________________。
参考答案:(1)第四周期?ⅤA族;4s24p3
(2)As;As的4p能级处于半充满的较稳定状态,比较难失去电子,故第一电离能较大
(3)
(4)4;正四面体;AlN;两者形成的晶体都是原子晶体,但AlN的键长较短,共价键较牢固,晶体的熔沸点较高?
(5)SiCl4?+3H2O?=?H2SiO3?+?4HCl↑
本题解析:
本题难度:一般
5、选择题 已知X、Y元素同周期,且电负性X >Y,下列说法中错误的是
[? ]
A.第一电离能Y小于X
B.气态氢化物的稳定性:HmY大于HnX
C.最高价含氧酸的酸性:X对应酸的酸性强于Y对应酸的酸性
D.X和Y形成化合物时,X显负价,Y显正价
参考答案:B
本题解析:
本题难度:一般