微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+3、+5、-3
-2
|
下列叙述正确的是( )
A.X、Y元素的金属性?X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z的氢化物生成ZW
参考答案:W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素.
A、X为镁元素,Y为铝元素,同周期自左而右,金属性减弱,故金属性X>Y,故A错误;
B、W为氧元素、Z为氮元素,两者的单质一定条件下直接生成NO,故B错误;
C、Y是Al,Al的最高价氧化物的水化物是氢氧化铝,氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,氢氧化铝不溶于氨水,故C错误;
D、一定条件下,氧气可以和氨气反应生成水和NO,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔、沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
参考答案:A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4的两元素有Li和Be、C和O、F和Mg、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.A为C元素,C为O元素,D为H元素,则B为N元素.X、Y、Z分别为CH4、NH3、H2O.
A、非金属性越强,氢化物越稳定,同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,所以CH4、NH3、H2O的稳定性逐渐增强,故A错误;
B、由于C元素有非常多的同素异形体金刚石、石墨、C60、C70、C100等,氧元素只存在O2、O3等,故B错误;
C、NH3分子间形成氢键比CH4分子间作用力大,沸点高,水常温是液体,沸点最高,所以X、Y、Z三种化合物的熔、沸点逐渐升高,故C正确;
D、四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物,故D正确.
故选:CD.
本题解析:
本题难度:简单
3、选择题 下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
参考答案:A、铵盐是离子化合物,含有离子键,由非金属元素组成,故A错误;
B、同周期自左而右,金属性减弱,故ⅠA族金属元素是同周期中金属性最强的元素,故B正确;
C、同种元素的不同核素质子数相同,中子数不同,故C错误;
D、ⅦA族阴离子还原性越强,元素的非金属性越弱,最高价氧化物对应水化物的酸性越弱,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 短周期元素A、B、C,原子序数依次递增.已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.常温下,B的硫酸盐溶液pH<7
D.5.6g铁与足量的C化合,转移0.3mol电子
参考答案:根据A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.设出B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,
A、B和C在同一周期,从左到右半径在减小,则B>C,原子半径为B>C>A,故A错误;
B、A的氢化物为水,分子中含有氢键,则沸点高,即A的氢化物的沸点高于C的氢化物,故B错误;
C、常温下,B的硫酸盐溶液中因铝离子的水解使溶液显酸性,即pH<7,故C正确;
D、因铁与硫反应生成FeS,5.6g铁与足量的C化合,转移0.2mol电子,故D错误;
故选C.
本题解析:
本题难度:简单
5、简答题 不同元素的原子在分子内吸引电子的能力大小可用x表示,x越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的x值.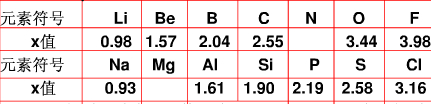
(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:______、N:______.
(2)短周期元素x值的变化特点体现了元素性质的______变化规律.
(3)某有机物分子中含有S-N键,你认为电子对偏向______原子(填元素符号).
(4)经验规律告诉我们,当成键的两原子相应元素的x差值△x大于l.7时一般形成离子键,△x小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是______.设计实验验证你的预测______.
参考答案:(1)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57;同理,在同周期中电负性C<N<O,同主族N>P,
最小范围应为2.55~3.44;故答案为:0.93~1.57;2.55~3.44.
(2)因每隔一定数目的原子,元素的电负性逐渐增大,这种变化称为周期性,故答案为:周期性.
(3)因N的电负性大于S的电负性,所以N吸引电子的能力强,故答案为:N.
(4)因同主族,电负性逐渐减小,故Br的电负性小于3.16,所以AlBr3中Al与Br的电负性差值<1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlBr3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电.故答案为:共价键;测定熔融状态下是否导电,若不导电则为共价键.
本题解析:
本题难度:一般