微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 大理石规格
| HNO3浓度/mol·L-1
| 实验目的
|
①
| 298
| 粗颗粒
| 2.00
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和__探究温度对该反应速率的影响;
(Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。
|
②
| ?
| ?
| ?
|
③
| ?
| 粗颗粒
| ?
|
④
| ?
| ?
| ?
|
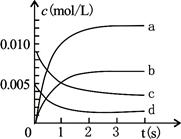
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)NO的平衡浓度c(NO)=?;
(2)用O2表示从0~2s内该反应的平均反应速率为?;
(3)右图中表示NO2变化的曲线是?;
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V?②体积不变充入He气体 V?
参考答案:(15分)(每空1分)(I)
实验编号
T/K
大理石规格
HNO3浓度/mol·L-1
实验目的
①
298
粗颗粒
2.00
⑴实验①和②探究HNO3浓度对该反应速率的影响;
⑵实验①和③探究温度对该反应速率的影响。
⑶实验①和④探究大理石规格(粗、细)对该反应的影响。
②
298
粗颗粒
1.00
③
308
粗颗粒
2.00
④
298
细颗粒
2.00
(II)0.0035mol·L-1?(2)0.0015mol·L-1·s-1;(3)b?(4) 增大?不变
本题解析:(I)要探究温度对该反应速率的影响,则其它条件应该是相同的,所以实验①和③探究温度对该反应速率的影响;要探究探究大理石规格(粗、细)对该反应速率的影响,其它条件应该是相同的,所以实验①和④探究大理石规格(粗、细)对该反应的影响。
(II)(1)根据比值数据可知,反应进行到3s时达到平衡状态,则NO的平衡浓度c(NO)=0.007mol÷2L=0.0035mol/L。
(2)从0~2s内NO的物质的量减少了0.020mol-0.008mol=0.012mol,则氧气减少了0.006mol,所以用氧气表示的反应速率是 。
。
(3)平衡时NO2的物质的量增加了0.020mol-0.007mol=0.013mol,浓度是0.013mol÷2L=0.0065mol/L,所以b曲线符合。
(4)升高温度,反应速率增大。体积不变充入He气体,压强增大,但物质的浓度是不变的,因此反应速率不变。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,在注重对学生基础知识的巩固和训练的同时,侧重对学生基础知识的巩固和训练。有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该类试题主要是考查学生能够敏捷、准确地获取试题所给的相关信息,并与已有知识整合,在分析评价的基础上应用新信息的能力。
本题难度:一般
2、选择题 下列各组实验中反应速率最快的是
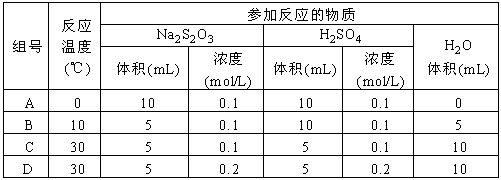
参考答案:D
本题解析: 反应的速率于反应温度和物质的浓度有关,本题主要比较温度和浓度对化学反应速率的影响。溶液混合后总体积都相同,从温度方面判断C、D的反应速率大于A、B的反应速率;从浓度方面判断,A、D的反应速率大于B、C的反应速率,所以反应速率最快的为D。
考点:外界条件对反应速率的影响
本题难度:一般
3、选择题 化学反应的速率和限度是化工厂研究的主要问题之一。下列对化学反应速率和限度的认识正确的是:
A.决定化学反应速率的因素主要是温度、浓度、压强和催化剂
B.化学反应速率常用一段时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示
C.对于可逆反应,当进行到一定程度时,正反应和逆反应速率相等,各物质浓度相等
D.改变反应条件可以在一定程度上改变可逆反应的限度即改变该反应的化学平衡状态
参考答案:D
本题解析:化学反应速率主要由物质的本身特性决定,通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示;对于可逆反应,当进行到一定程度时,正反应和逆反应速率相等,各物质浓度不再改变
本题难度:一般
4、填空题 (8分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加少许的MnO2粉末于 50 mL密度为1.1g?cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。请依图回答下列问题:
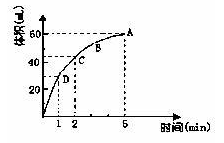
(1)实验时放出气体的总体积为? ___?;
(2)放出一半气体所需要的时间为? ___?;
(3)ABCD四点化学反应速率的由快到慢顺序为 ____? _______ ;
(4)在5min后,收集到的气体体积不再增加,原因是?。
参考答案:(8分) (1)60mL?;?(2)1min?;?(3) D>C>B>A ;(每空2分)?
(4)此时双氧水已经完全分解;(2分)
本题解析:(1)根据图像可知,当气体的体积达到60ml时,就不再发生变化,所以实验时放出气体的总体积是60ml。
(2)当反应中生成3ml气体时,所用的时间是1min。
(3)反应速率越大,反映在曲线上,斜率就越大,所以ABCD四点化学反应速率的由快到慢顺序为D>C>B>A。
(4)5min后,收集到的气体体积不再增加,这说明反应物双氧水已经完全分解,不再产生氧气。
本题难度:一般
5、选择题 下列说法错误的是
A.做一次完整的中和热测定实验,温度计至少需使用3次
B.在有盐桥构成的铜(硫酸铜)-锌(硫酸锌)原电池中,盐桥中的阳离子移向电池的锌极
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.可以借助分光光度计采用比色的方法测定某反应的化学反应速率