|
高中化学必备知识点《有关氧化还原反应的计算》考点巩固(2017年最新版)(六)
2017-07-18 02:18:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2
B.+3
C.+4
D.+5
|
参考答案:B
本题解析:根据氧化还原反应得失电子总数相等,判断Cr元素在还原产物里的价态。
n(Na2SO3)=0.05mol·L-1×0.024L=0.0012mol,
n(K2Cr2O7)=0.02mol/L×0.02L=0.0004mol。
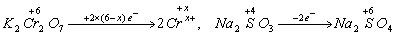
K2Cr2O7在反应中得电子:0.0004×2(6-x)mol e-;
Na2SO3在反应中失电子:0.0012×2mol e-。
根据氧化还原反应中,氧化剂和还原剂在反应中得失电子数相等,则有:
0.0004×2(6-x)=0.0012×2,解得x=3。此题选B。
考点:考查氧化还原反应中电子转移等相关计算。
本题难度:困难
2、选择题 从硫元素的化合价判断,含硫元素的下列物质只做还原剂的是
A.Na2S
B.S
C.SO2
D.H2SO4
参考答案:A
本题解析:略
本题难度:简单
3、选择题 有关氧化还原反应的下列叙述正确的是
A.氧化剂发生还原反应,还原剂发生氧化反应
B.氧化剂被氧化,还原剂被还原
C.在氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D.氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
参考答案:A
本题解析:A、氧化剂得到电子,发生还原反应。还原剂失去电子,发生氧化反应,A正确;B、氧化剂得到电子,被还原。还原剂失去电子,被氧化,B不正确;C、在氧化还原反应中,氧化剂和还原剂不一定是两种不同的物质,也可能是自身的氧化还原反应,例如氯气与氢氧化钠溶液的反应等,C不正确;D、氧化还原反应中,金属单质只作还原剂,非金属单质既可以作氧化剂,也可以作还原剂,D不正确,答案选A。
本题难度:一般
4、填空题 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
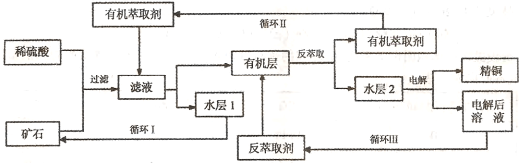
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O、
?、?。(写出其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式?。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个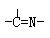 三种基团,无环状结构,三种基团的数目关系为n3=?。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是?。 三种基团,无环状结构,三种基团的数目关系为n3=?。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是?。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式?。
(5)该工艺最大亮点是它符合下列原理?(填字母,下同)。
A.化学平衡? B.绿色化学? C.质量守恒? D.能量守恒
E.相似相溶? F.酸碱中和? G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有?。
A.两种方案? B.三种方案? C.四种方案? D.五种方案
参考答案:(1) CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
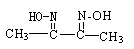
(2)4Fe2++O2+4H+=4Fe3++2H2O
(3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2? (5)B(6)A
本题解析:本题以“酸浸法从矿石中提取铜”为载体,考 查学生对化学的环境价值、有机物化学键的计算、离子反应方程式书写、电化学中极反应式的书写、Cu、Fe及其化合物等知识的掌握情况,以及应用相关知识解决实际问题的能力,具有较强的综合性。
矿石中含有氧化铜、氧化亚铜、三氧化二铁和脉石(Si02)等物质,其中氧化铜、氧化亚铜、三氧化二铁能与稀硫酸反应,但考生要注意氧化亚铜与稀硫酸生成的铜与三氧化二铁与稀硫酸生成的Fe3+反应。得到的溶液中含有较多的Fe2+能被空气中的氧化,要注意溶液是酸性的,H+参加反应。
本题难度:困难
5、选择题 2H2O2=2H2O+O2 2KClO3=2KCl+3O2 2HgO=2Hg+O2 2Na2O2+2CO2=2Na2CO3+O2,
现要制备等量的O2,则转移的电子数之比为 ( )
A.1:1:1:1
B.1:2:2:1
C.2:1:1:2
D.1:2:1:2
|