微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上粗硅的生产原理为2C+SiO2 Si+2CO↑,其中SiO2是
Si+2CO↑,其中SiO2是
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
参考答案:A
本题解析:2C+SiO2 Si+2CO↑中,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳是还原剂,二氧化硅是氧化剂,故选A.
Si+2CO↑中,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳是还原剂,二氧化硅是氧化剂,故选A.
本题难度:一般
2、选择题 下列有关化学用语表示正确的是(?)
A.Be原子的结构示意图: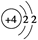
B.乙酸的结构简式: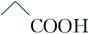
C.中子数为16的硫原子: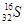
D.NH4Cl的电子式: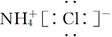
参考答案:A
本题解析:B项,乙酸的结构简式为CH3—COOH,该项中多了一个CH2,错误;C项,应表示为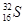 ;D项,NH4Cl的电子式应为
;D项,NH4Cl的电子式应为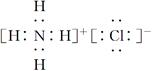 。
。
本题难度:一般
3、选择题 在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是(?)
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂
C.该过程中溴元素被还原,氧元素被氧化
D.该过程中溴元素发生氧化反应,氧元素发生还原反应
参考答案:D
本题解析:在Br-中Br元素的化合价为-1价,在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐中的Br的化合价是+5价,该过程中溴化物(Br-)失去电子,被氧化,发生氧化反应,作还原剂,而臭氧(O3)中的氧元素得到电子,被还原,发生还原反应,作氧化剂。因此有关该转化过程的认识正确的是该过程中溴元素发生氧化反应,氧元素发生还原反应,选项正确的是D。
本题难度:一般
4、填空题 2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: 。
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:

请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-) (若不存在,此问不必作答)。
参考答案:(1)2.5 (2)FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的 (3)①100ml容量瓶 ②Al(OH)3+OH-=AlO2-+2H2O
③存在;0.15mol/L
本题解析:(1)ClO2和Cl2的还原产物都为Cl-,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍;
(2)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的;
(3)①配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+无Fe2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、SO42-,已知硫酸钡沉淀为2.33g,则n(SO42-)=2.33g÷233g/mol=0.01mol, 根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Fe2++2OH-=Fe(OH)2↓
n(Al3+ 0.005mol n(Fe2+) 0.035-3n(Al3+)
所以n(Al3+)=0.005mol,n(Fe2+)=0.01mol
因此溶液中Fe2+和Al3+所带正电荷与SO42-所带负电荷不相等,所以存在NO3-
设NO3-物质的量为nmol,根据电荷守恒得:3n(Al3+)+2n(Fe2+)=2n(SO42-)+n(NO3-)
即n(NO3-)=0.015mol,所以c(NO3-)
本题难度:困难
5、选择题 下列计算结果正确是( )
A.标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为(
)mol/L
B.标准状况下,将64g?铜片投入到100ml?18?mol/L的浓硫酸中加热会产生22.4?L的SO2气体
C.向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸会产生1mol的CO2气体
D.向含有1mol?Ba(OH)2溶液中通入1molCO2气体就会产生1mol?Ba(HCO3)2的白色沉淀
参考答案:A、令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为VL22.4L/mol=V22.4mol,氨水溶液的物质的量浓度为V22.4molVL=122.4mol/L,故A正确;
B、发生反应Cu+2H2SO4?△?.?CuSO4+SO2↑+2H2O,64g铜的物质的量为1mol,硫酸的物质的量为0.1L×18mol/L=0.18mol,由方程式可知,硫酸不足量,且随反应进行浓硫酸变为稀硫酸,铜与稀硫酸不反应,故1mol铜不能完全反应,生成的SO2气体小于1mol,体积小于22.4L,故B错误;
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳,是否生成二氧化碳及二氧化碳体积多少,与盐酸的量有关,故C错误;
D、1mol?Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol?BaCO3白色沉淀,故D错误;
故选A.
本题解析:
本题难度:一般