| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《难溶电解质的溶解平衡》高频试题特训(2017年最新版)(十)
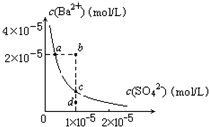 参考答案:A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故A错误; 本题解析: 本题难度:简单 4、选择题 一定温度下,下列叙述正确的是( ) 参考答案:A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,溶度积只受温度的影响,溶度积不变,故A错误; 本题解析: 本题难度:简单 5、填空题 碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
(1)氯酸钠的作用是 ;滤渣的主要成分是 (写化学式)。 (2)调节反应A后溶液的pH范围应为 。可以选择的试剂是 (填序号)。 a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜 (3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。(写化学式) (4)过滤得到的产品洗涤时,如何判断产品已经洗净? 。 (5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。 ① 若沉淀只有CuCO3,则相应的离子方程式为 。 ② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程 。 ③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明 。 (6)碱式碳酸铜组成可表示为:aCuCO3?bCu(OH)2?cH2O,现通过下列方案测定其组成。步骤如下: ① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。 请对上述测定方案作出评价。 。 参考答案: 本题解析:(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3。(2)调节反应A后溶液的pH范围应为3.2-4.2。可以选择的试剂是碳酸铜,且不引进新的杂质。(3)反应B的温度如过高,碱式碳酸铜可能会出现的杂质是氧化铜。(4)取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净。(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。① 若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓。② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程CO32-+H2O 本题难度:困难 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《有关氧化还.. | |