微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:
N2(g)+O2(g)===2NO(g)?ΔH=+180.5?kJ/mol;
2C(s)+O2(g)===2CO(g)?ΔH=-221.0?kJ/mol;
C(s)+O2(g)===CO2(g)?ΔH=-393.5?kJ/mol。
尾气转化的反应之一:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH__________。
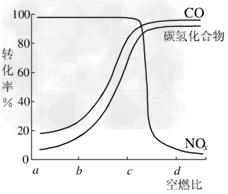
(2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。

①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、________等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如图所示。空燃比约为_______时,催化剂对汽车尾气的催化效果最好。
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是___________。

A.负极的电极反应式为:CO+O2--2e-===CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
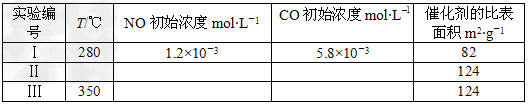
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据。
参考答案:(1)-746.5?kJ/mol
(2)?①催化反应的温度;②c
(3)?B
(4)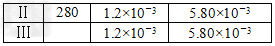
本题解析:
本题难度:一般
2、选择题 据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒、碳棒、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应
B.正极反应为: Zn-2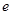 -=Zn2+
-=Zn2+
C.工作时电流由碳棒电极经外电路流向锌极
D.正极发生氧化反应
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据反应式可知,锌失去电子,作负极,氧气得到电子,在正极通入,所以只有选项C是正确的,其余都是错误的,答案选C。
本题难度:简单
3、选择题 实验室欲快速制取氢气,应选用的正确措施是
A.纯锌跟稀硫酸反应
B.粗锌跟稀硫酸反应
C.粗锌跟稀硝酸反应
D.锌跟滴有少量硫酸铜溶液的稀硫酸反应
参考答案:B
本题解析:
本题难度:一般
4、选择题 将0.1L含有0.02mol?CuSO4和0.01molNaCl的水溶液用惰性电极电解.电解一段时间后,一个电极上得到0.01mol?Cu,另一电极析出的气体( )
A.只有Cl2
B.只有O2
C.既有Cl2又有O2
D.只有H2
参考答案:溶液中含有n(Cu2+)=0.02mol,n(Cl-)=0.01mol;用惰性电极电解,电解一段时间后,一个电极上得到0.01mol Cu,是阴极反应,另一电极析出的气体为阳极反应;发生的电极反应为:根据得到铜物质的量计算电子转移,阳极电子转移守恒分析判断离子反应情况;
阳极电极反应:2Cl--2e-=Cl2↑;
?0.01mol 0.01mol
? 4OH--4e-=2H2O+O2↑
?0.01mol? 0.01mol
阴极电极反应:Cu2++2e-=Cu;
?0.02mol? 0.01mol
依据上述分析和计算得到,阳极反应生成的气体是氧气和氯气;
故选C.
本题解析:
本题难度:一般
5、选择题 铜锌原电池装置(见图),下列分析正确的是
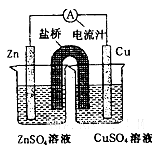
A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B.原电池工作时,Cu电极流出电子,发生氧化反应
C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
参考答案:C
本题解析:A.一段时间后左烧杯中c(Zn2+)增大,盐桥中的阴离子进入,使电荷守恒;右烧杯中c(Cu2+)均减小,盐桥中的阳离子进入,使电荷守恒。B.原电池工作时,是活泼电极Zn电极流出电子,发生氧化反应;D.盐桥中装有含氯化钾的琼脂,其作用是传递离子。
本题难度:一般