微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
选项
| 污染物
| 处理措施
| 方法类别
|
A
| 废酸
| 加生石灰中和
| 物理法
|
B
| Cu2+等重金属离子
| 加硫酸盐沉降
| 化学法
|
C
| 含纯碱的废水
| 加石灰水反应
| 化学法
|
?
(2)下图是某市污水处理的工艺流程示意图:
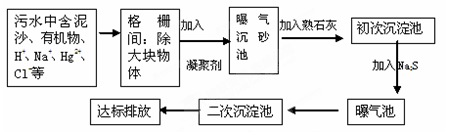
① 下列物质中不可以作为混凝剂(沉降剂)使用的是?(填字母编号,可多选)。
A.偏铝酸钠? B.氧化铝? C.碱式氯化铝? D.氯化铁
② 混凝剂除去悬浮物质的过程是?(填字母编号)。
A.只是物理过程? B. 只是化学过程? C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O?再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯?g。
参考答案:(1)C?(2)①B?②C?(3)2,4,3,2,1,6,2? 35.5
本题解析:(1)污染治理要求能除掉有毒的物质,新生成的物质对环境无污染,物理法与化学法的区别是否有新物质生成。A、酸和碱的中和反应为化学反应,为化学法,故A错误; B、硫酸铜可溶,所以不能沉淀除去,故B错误;D.碱性的废水与二氧化碳反应生成的碳酸盐和水,无污染,故D正确;
(2)①氧化铝在水中不能水解,不能生成胶状物或絮状沉淀,不能用作混凝剂,而偏铝酸钠、碱式氯化铝、氯化铁在溶液中易水解生成胶体可作为混凝剂;②混凝剂能使固体颗粒沉淀,且混凝剂在水中发生水解是化学变化,故混凝剂除去悬浮物质的过程是物?理和化学过程。
(3)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O;废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为13g /(65g/mol )=0.2mol,使KCN完全转化为无毒物质,应生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g。
本题难度:一般
2、选择题 硫酸铵在强热下分解,生成氨气、二氧化硫、氮气和水,反应中生成的氧化产物和还原产物的分子个数比为多少
[? ]
A、3:1
B、1:3
C、1:1
D、4:3
参考答案:B
本题解析:
本题难度:简单
3、填空题 (12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
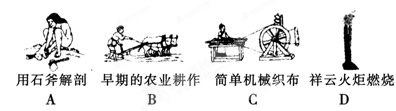
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用 如图表达。
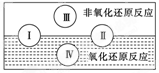
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:?
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是?。
参考答案:(1)D?(2)C+H2O(g) CO+H2(2分)?氧化(合理即可)
CO+H2(2分)?氧化(合理即可)
(3)①4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4(2分)
2Fe2(SO4)3+2H2SO4(2分)
②1? 10? 4? 2? 10? 8? H+(2分)
(4)N2O(2分)
本题解析:(1)ABC都是物理变化,燃烧是氧化还原反应,答案选D。
(2)Ⅳ是置换反应,所以方程式可以是C+H2O(g) CO+H2,在该反应中水是氧化剂。
CO+H2,在该反应中水是氧化剂。
(3)①溶液酸性增强,说明反应中还生成硫酸,所以方程式为4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4。
2Fe2(SO4)3+2H2SO4。
②根据原子守恒可知,另一种生成物是氢离子。1molCu2S失去10mol电子,所以需要氧化剂Fe3+是10mol,然后观察法配体其它的。
(4)设羟胺的氧化产物中氮元素的化合价是n,则根据电子的得失守恒可知,25×0.049×(n+1)=24.5×0.020×(7-2),解得n=1,所以氧化产物是N2O。
本题难度:一般
4、选择题 氧化还原反应的实质是
A.氧元素的得与失
B.化合价的升降
C.电子的得失或偏移
D.分子中原子重新组合
参考答案:C
本题解析:氧化还原反应的实质是电子的得失或偏移,而化合价升降只是一种表现,是判断氧化还原反应的依据,答案选C。
点评:该题是基础性试题的考查,学生只要明确氧化还原反应的实质和特征就不难判断,该题难度不大,学生较易得分。
本题难度:简单
5、填空题 (14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
参考答案:(1)5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O?(2)KMnO4?氧(O)? 6.02×1023
(3)2H2O2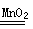 2H2O+O2↑? 3.01×1023
2H2O+O2↑? 3.01×1023
本题解析:(1)根据电子的得失守恒可知,氧化反应和还原反应合并后的方程式为
5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O。
(2)氧化剂得到电子,被还原,发生还原反应,所以氧化剂是KMnO4;失去电子,化合价升高的是还原剂,所以被氧化的元素是氧;根据方程式可知,氧元素的化合价从-1价升高到0价,所以1molH2O2在反应中失去2个电子,因此转移电子是6.02×1023。
(3)H2O2分解生成氧气和水,方程式为2H2O2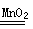 2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
本题难度:一般