微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中属于电解质的是
A.CO2
B.盐酸溶液
C.Fe
D.CuSO4
参考答案:D
本题解析:分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
解答:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
A、二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故A错误;
B、盐酸溶液是混合物,所以不是电解质,故C错误;
C、铁是单质,所以铁既不是电解质也不是非电解质,故C错误;
D、硫酸铜在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以硫酸铜是电解质,故D正确;
故选D.
点评:本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.
本题难度:简单
2、选择题 下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集Cl2:Cl2+H2O?H++Cl-+HClO
B.热的纯碱溶液碱性增强:?
C.向Mg(OH)2悬浊液中加入FeCl3溶液:
D.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)?TiO2.xH2O↓+4HCl
参考答案:BC
本题解析:分析:A.氯气与水的反应为可逆反应;
B.碳酸根离子水解分步进行,以第一步为主;
C.氢氧化铁的溶解度比氢氧化镁的小,沉淀转化为可逆反应;
D.四氯化钛水解生成沉淀和HCl.
解答:A.氯气溶于水发生Cl2+H2O?H++Cl-+HClO,饱和食盐水中氯离子浓度较大,抑制氯气的溶解,故A正确;
B.纯碱溶液存在CO32-+H2O?HCO3-+OH-,水解为吸热反应,加热促进水解,碱性增强,故B错误;
C.氢氧化铁的溶解度比氢氧化镁的小,则向Mg(OH)2悬浊液中加入FeCl3溶液发生3Mg(OH)2(s)+2Fe3+?2Fe(OH)3(s)+3Mg2+,故C错误;
D.四氯化钛水解,则用TiCl4制备TiO2的离子反应为TiCl4+(x+2)H2O(过量)?TiO2.xH2O↓+4HCl,故D正确;
故选BC.
点评:本题考查离子反应方程式的书写,涉及化学平衡、水解平衡、沉淀转化等离子反应,综合性较大,题目难度中等.
本题难度:困难
3、选择题 向10mL 0.1mol·L-1?NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是? (? )
A.x=10时,溶液中有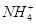 、
、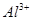 、
、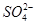 ,且
,且
B.x=10时,溶液中有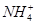 、
、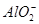 、
、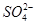 ,且
,且
C.x=30时,溶液中有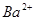 、
、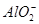 、
、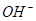 ,且
,且
D.x=30时,溶液中有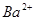 、
、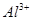 、
、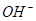 ,且
,且
参考答案:A
本题解析:
为了方便计算,可以把溶液的体积都扩大100倍,1000,mL 0.1mol·L-1?NH4Al(SO4)2溶液中含有0.1molNH4+ ,0.1mmolAL3+,0.2mmolSO42-,1000ml等浓度Ba(OH)2溶液有0.1mol Ba2+,0.2molOH-,混合后硫酸钡沉淀,剩余0.1mol SO42-。氢氧化铝沉淀,剩余AL3+,所以A答案对。由于氢氧根离子的物质的量小于AL3+3倍,所以溶液中还含有AL3+,没有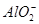 ,故B错
,故B错
同理,当Ba(OH)2体积扩大3倍时,溶液中0.3mol Ba2+,0.6molOH-,混合后,剩余0.1mol Ba2+
,生成了偏铝酸根,故C、D错。3+与OH-反应关系式
点评:本题难度大,但是只要将两种溶液中所含的离子的物质的量全部都计算出来,根据相应的化学方程式序数关系,即可计算出溶液中存在哪些离子。
本题难度:一般
4、填空题 离子反应向着使溶液中___的方向进行,如生成___、____、 ____等。一些能自发进行的___反应也能使离子反应发生。
参考答案:离子总数减少 ;沉淀 ;气体 ;弱酸、弱碱、水 ;氧化还原
本题解析:
本题难度:简单
5、填空题 (8分)无色溶液X由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是(填化学式,下同)?,气体B的成分是:?
(2)溶液中一定存在的离子有:?。
可能存在的离子有:?。
参考答案:
 (1)CO2,NH3?(2) Na+、AlO2-、CO32-。? SO42-
(1)CO2,NH3?(2) Na+、AlO2-、CO32-。? SO42-
本题解析:(1)溶液X是无色的,所以一定没有MnO4-。加入盐酸能生成气体,则根据离子的种类可知,一定含有CO32-,因此一定不存在Ag+、Ba2+、Al3+,气体A是CO2。溶液Ⅱ中含有NH4+,能和强碱反应生成氨气,即B是氨气。
(2)由于溶液I能和碳酸氢铵反应生成白色沉淀,所以原溶液中一定含有AlO2-,和盐酸反应生成铝离子,进而和碳酸氢铵反应生成氢氧化铝白色沉淀。根据电荷守恒定律可知,一定含有钠离子,所以原溶液中含有的离子是Na+、AlO2-、CO32-。由于溶液Ⅱ中HCO3-,也能和氢氧化钡反应生成碳酸钡白色沉淀,即乙不一定是硫酸钡沉淀,所以原溶液中的SO42-不能确定。
本题难度:一般