微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
⑴Ea的大小对该反应的△H _______(填“有”或“无”)影响。
⑵已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:___________?________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。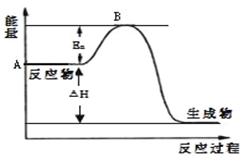
参考答案:⑴无? ⑵S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1? 1185kJ
本题解析:(1)Ea表示反应的活化能,活化能的大小与反应热大小无关系。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1。
(3)根据盖斯定律可知,S(s)+3/2 O2(g)="=" SO3(g)△H =-395kJ·mol-1。 所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
本题难度:一般
2、选择题 下列反应中旧化学键断裂吸收的总能量大于新化学键形成放出总能量的是
A.电解水制取H2和O2
B.甲烷燃烧
C.铝粉与氧化铁粉末反应
D.油脂在人体内完全氧化生成CO2和H2O
参考答案:A
本题解析:反应中旧化学键断裂吸收的总能量大于新化学键形成放出总能量,这说明该反应是吸热反应,因此选项A正确,其余选项都是放热反应,答案选A。
本题难度:一般
3、选择题 已知盐酸与硫酸跟烧碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
A.Q1=Q2
B.2Q1=Q2
C.Q1<Q2
D.无法判断
参考答案:B
本题解析:两个反应都是强酸、强碱稀溶液的反应,第二个反应生成2 mol H2O,是第一个反应生成水的2倍,故Q2=2Q1。
本题难度:一般
4、选择题 碘与氢气反应的热化学方程式是
①I2(g) + H2(g)  2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1
②I2(s) + H2(g)  2HI(g) ΔH =" +26.48" kJ·mol-1
2HI(g) ΔH =" +26.48" kJ·mol-1
下列说法正确的是(?)
A.①的产物比②的产物稳定
B.I2(s) = I2(g) ΔH=" +17.00" kJ·mol-1
C.②的反应物总能量比①的反应物总能量低
D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ
参考答案:C
本题解析:①的产物和②的产物都是HI,稳定性相同,A不正确;关键盖斯定律可知,②-①即得到I2(s)=I2(g),则ΔH=26.48kJ/mol+9.48kJ/mol=+35.96kJ/mol,选项B不正确;固体碘的能量低于气态的的能量,所以②的反应物总能量比①的反应物总能量低,C正确;该反应是可逆反应,则1mol I2(g)中通入1 mol H2(g),发生反应时放热一定小于9.48kJ,D不正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生对反应热含义以及利用盖斯定律计算反应热的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力和学习效率。
本题难度:简单
5、选择题 下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2===SO2 ΔH=-297.3 kJ/mol
参考答案:C
本题解析:气态水的能量高于液态水的能量,所以氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量少,A不正确;反应条件与反应是放热反应或吸热反应无关系,B不正确;浓硫酸溶于水放出大量的热,C正确;D不正确,没有注明物质的状态,答案选C。
本题难度:一般