微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 I、Ⅱ、Ⅲ、Ⅳ是某活动小组研究可逆反应:X2(g)+3Y2(g)?2XY3(g);△H<O在一容积可变的密闭容器中控制某一条件时的图象

有关图象分析正确的是( )
A.图象I是研究不同压强条件下,X2的转化率
B.图象Ⅱ是研究t0时使用正催化剂,正逆反应速率均加快
C.图象Ⅲ是t0时,在恒温条件下,充入nmolX2气体且使体积增大(n-2)L,n>2时速率的变化
D.图象Ⅳ是研究不同温度条件下,Y2的浓度变化
参考答案:A、增大压强,反应速率加快,到达平衡时间短,可逆反应:X2(g)+3Y2(g)?2XY3(g)向正反应方向移动,X2的转化率增大,图Ⅰ中到达平衡时间越短,X2的转化率越小,应为升高温度,故A错误;
B、加入催化剂,正逆反应速率同倍增加,但平衡不发生移动,图Ⅱ中瞬间正、逆反应速率增大,平衡向正反应移动,应为增大压强,故B错误;
C、充入nmolX2气体且使体积增大(n-2)L,n>2时,X2的浓度增大,平衡向正反应移动,XY3(g)的浓度降低,逆反应速率降低,图象Ⅲ符合,故C正确;
D、升高温度,反应速率加快,到达平衡时间短,可逆反应:X2(g)+3Y2(g)?2XY3(g)△H<O,向逆反应反应方向移动,平衡时Y2的难度增大.图象Ⅳ中到达平衡时间越短,Y2的浓度越小,应为增大压强或增大X2的浓度,故D错误.
故选:C.
本题解析:
本题难度:简单
2、填空题 (8分)在体积不变的密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g) 2HI(g) △H<0
2HI(g) △H<0
改变下列条件后,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ; (2)加入催化剂 ;
(3)充入更多的H2 ; (4)容器容积不变,通入氖气 。
参考答案:(8分)(1)增大;(2)增大(3)增大;(4)不变
本题解析:(1)升高温度,增大活化分子的百分数,反应速率增大;
(2)加入催化剂,可以降低反应的活化能,活化分子的百分数增大,反应速率增大;
(3)充入更多的H2,则反应物的浓度增大,反应速率增大;
(4)容器容积不变,通入氖气,虽然容器的压强增大,但反应体系中各物质的浓度不变,所以反应速率不变。
考点:考查条件对反应速率的影响
本题难度:一般
3、选择题 向某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+B(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时问的变化如图所示:
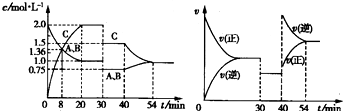
下列说法中正确的是( )
A.30~40?min时间段该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30?min时降低温度,40?min时升高温度
D.8?min前A的平均反应速率为0?08?mol?L-1?min-1?
参考答案:A.由图象可知,30~40?min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
B.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 (14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。?
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。?
(1)写出滴定过程中发生反应的化学方程式为???。?
(2)滴定过程中操作滴定管的图示正确的是???。
 ?
?
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度??(填“偏高”、“偏低”、或“不变”)。?
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1?。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
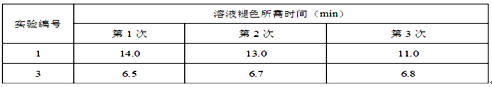
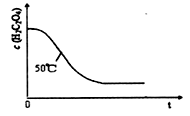
(4)写出表中a?对应的实验目的???;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线?如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。?
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):?
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案?______________________。?
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为??。
参考答案:(1)? 2MnO4—+5H2C2O4+6H+=?2Mn2+?+?10CO2?↑+?8H2O?;(2) A;(3)?偏高?;
(4)探究温度不同对反应速率的影响
25℃?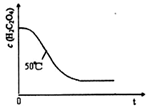 ?
?
(5)其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。?
(6)2MnO4—+?10Cl—?+?16H+?=?5Cl2↑+?2Mn2+?+?8H2O
本题解析:(1) 酸性KMnO4有强氧化性,而草酸有还原性,二者发生氧化还原反应。离子方程式为: 2MnO4—+5H2C2O4+6H+=?2Mn2+?+?10CO2?↑+?8H2O?;(2)滴定过程中操作酸式滴定管的方法是图示的A。(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,则消耗的酸性KMnO4标准溶液读数偏大,以此为标准计算的草酸溶液浓度?就偏高。(4)由于a点对应的其它条件都相同,只有温度不同,因此表中a?对应的实验目的是探究温度不同对反应速率的影响。(5)甲同学改进的实验方案是其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。?溶液褪色时间越短,则反应速率越快。(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因是Cl-有还原性,也会与酸性KMnO4标准溶液反应,而影响实验结果的测定,可用离子方程式表示为2MnO4— +?10Cl— +?16H+?=?5Cl2↑+?2Mn2+?+?8H2O?。
本题难度:一般
5、填空题 (8分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
T/K
| 303
| 313
| 323
| 353
|
NH3生成量/(10-6mol)
| 4.8
| 5.9
| 6.0
| 2.0
|
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+ O2(g)?ΔH
O2(g)?ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
回答下列问题:
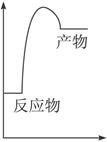
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:?。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为 。计算
。计算
①该条件下N2的平衡转化率是?;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为?
N2(g)+3H2(g)的平衡常数为? ?。
?。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将----------------------(填增大、减小或不变)?
参考答案:(1)画图略。(2分)
(2)升高温度,增大反应物N2的浓度,不断移出生成物(2分)
(3)66 .7%(2分)?0.005(2分)
.7%(2分)?0.005(2分)
本题解析:(1)作图要点:①催化剂 可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
②该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)该反应的正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3的生成量,升高温度也能提高反应速率;增大反应物N2的浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物,使平衡向右移动,增大NH3的生成量。
(3)由三行式法计算可知,起始时,c(N2)=0.3mol·L-1。平衡时,c(N2)=0.1 mol·L-1;?c(H2)=0.2? mol·L-1;c(NH3)=0.4? mol·L-1。
①所以N2的平衡转化率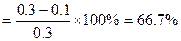 。
。
④?反应2NH3(g)====N2(g)+3H2(g)的平衡常数 。
。
本题难度:一般