微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 表示氢气燃烧热的是( )
A.H2(g)+
O2(g)=H2O(g)△H=-241.8?kJ/mol
B.2H2(g)+O2(g)=2H2O(g)△H=-483.6?kJ/mol
C.H2(g)+O2(g)=H2O(l)△H=-285.8?kJ/mol
D.2H2(g)+O2(g)=2H2O(l)△H=-571.6?kJ/mol
参考答案:A、水的状态为气态,产物为不是稳定氧化物,△H不代表燃烧热,故A错误;
B、氢气的化学计量数为2,△H不代表燃烧热,故B错误;
C、H2的化学计量数为1,产物是稳定氧化物,△H代表燃烧热,故C正确;
D、H2的化学计量数为2,产物是稳定氧化物,△H不代表燃烧热,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:
①pH=3的醋酸bL;②物质的量浓度为1×10-3 mol/L的醋酸c L;③ c(OH-)=1×10-11 mol/L的H2SO4的溶液d L。判断a、b、c、d的大小关系,正确的是
A.c>b>a=d
B.b>a=d>c
C.c>a>d>b
D.c>a=d>b
|
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (4分)在温度t℃下,某NaOH的稀溶液中c(H+)=10?a mol/L,c(OH?)=10?b mol/L,已知a+b=12,该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示,假设溶液混合前后的体积变化忽略不计,则c为_____________ 。
序号
| NaOH溶液的体积/mL
| 盐酸的体积/mL
| 溶液的pH
|
①
| 20.00
| 0.00
| 8
|
②
| 20.00
| 20.00
| 6
参考答案:1×10-12;(1分)?大于;(1分)? 4? (2分)
本题解析:略
本题难度:简单
4、选择题 水的电离平衡曲线如图所示,下列说法不正确的是?(?)
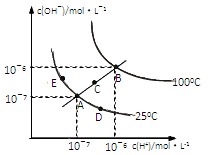
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化
参考答案:C
本题解析:根据图像可知,ADE三点的温度相同,都小于C点,C点小于B点。由于电离是吸热的,所以水的离子积常数随温度的升高而增大,A正确,D不正确。从A→D,氢离子浓度增大,所以在温度不变时,加入酸即可,B正确。B点根据图像可知,水的离子积常数是1×10-12,所以pH=10的KOH溶液的浓度是0.01mol/L,因此酸和碱恰好反应,溶液显中性,C正确。答案选D。
本题难度:一般
5、选择题 莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定的基准物质,在1 L 0.1 mol/L的该盐溶液中,下列有关比较正确的是 (?)
A.c(NH4+)+c(NH3·H2O) =" 0.1" mol/L
B.2c(Fe2+)+c(NH4+) = 2c(SO42-)
C.c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
D.c(NH4+)∶c(Fe2+)∶c(SO42-) = 2∶1∶2
参考答案:C
本题解析:A.根据NH4++H2O?H++NH3?H2O知,氮原子有两种存在形式,即NH4+、NH3?H2O,根据氮原子守恒,c(NH3?H2O)+c(NH4+)=0.2mol/L,故A错误;
B.在 (NH4)2Fe(SO4)2?6H2O溶液中,存在NH4+、Fe2+、SO42-、OH-、H+,由电荷守恒得:2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+),故B正错误;
C.在(NH4)2Fe(SO4)2?6H2O溶液中,存在NH4+、Fe2+、SO42-、OH-、H+,由于 NH4+、Fe2+都水解,导致二者的浓度都减小,即 c(NH4+)<0.2mol/L,c(Fe2+)<0.1mol/L,NH4+、Fe2+水解使溶液呈酸性,即 c(H+)>c(OH-).因为盐类水解程度较小,因此 c(Fe2+)>c(H+),则c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故C正确;
D.根据质子守恒,水电离产生的H+与OH-数目相等,结合NH4++H2O?H++NH3?H2O和Fe2++2H2O?Fe(OH)2+2H+,可得c(H+)=c(OH-)+c(NH3?H2O)+2Fe(OH)2,故D错误。
故选C。
点评:本题比较典型,全面考查了盐类的水解、电荷守恒、质子守恒、物料守恒等,仔细研究,定会有所提高。
本题难度:简单
|