微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了除去粗盐中Ca2+ 、 Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序 ①过滤 ②加过量的NaOH ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
[? ]
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
参考答案:CD
本题解析:
本题难度:简单
2、选择题 浓度为0.50 mol/L某金属阳离子Mn+的溶液10.00 mL,与0.40 mol/LNaOH溶液12.50 mL恰好完全反应生成沉淀,则n等于
A.1
B.2
C.3
D.4
参考答案:A
本题解析:该阳离子在溶液中的物质的量n(Mn+)=0.50 mol/L×10.00 mL×10-3 L/mL=5×10-3 mol,NaOH溶液中氢氧根离子的物质的量为(OH-)=0.40 mol/L×12.50 mL×10-3 L/mL=5×10-3 mol,两者物质的量相等,且正好生成沉淀,故n=1.
本题难度:简单
3、选择题 选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且碘单质在萃取剂溶解度比水中更大
C.不溶于水,且密度必须比水大
D.不溶于水,且密度必须比水小
参考答案:B
本题解析:
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列叙述错误的是
A.已知ZXm-的质量数为A,则ng该微粒中所含的电子数为(z+m)nNA/A
B.将硫溶于热的浓硫酸,当生成1mol二氧化硫时,转移电子的数目为4/3NA
C.1mol水分子所形成的氢键数目为2NA
D.12g熔融的NaHSO4中含有0.2NA个阳离子
参考答案:D
本题解析:分析:A、质量换算物质的量结合微粒质子数计算;
B、依据硫和浓硫酸反应生成二氧化硫和水的反应化学方程式中元素化合价变化计算电子转移数;
C、依据水分子中氧原子结构和氢键的形成实质计算判断;
D、硫酸氢钠熔融状态电离出的阳离子是钠离子.
解答:A、已知ZXm-的质量数为A,则ng该微粒物质的量=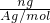 =
=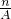 mol;ZXm-中电子数是z+m;所以
mol;ZXm-中电子数是z+m;所以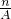 mol微粒中所含的电子数为(z+m)
mol微粒中所含的电子数为(z+m)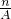 NA,故A正确;
NA,故A正确;
B、将硫溶于热的浓硫酸,发生的反应为:S+2H2SO4=3SO2↑+2H2O,反应中生成3mol二氧化硫转移电子为4mol,当生成1mol二氧化硫时,转移电子的数目为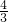 NA,故B正确;
NA,故B正确;
C、1mol水分子中氧原子有两对孤对电子,可以和氢原子形成2mol氢键,含有的2mol氢原子和其他水分子中的氧原子形成2mol氢键,1mol水分子平均所形成的氢键数目为2NA,故C正确;
D、硫酸氢钠熔融状态电离出的阳离子是钠离子,12g熔融的NaHSO4物质的量= =0.1mol,含阳离子为0.1mol,故D错误;
=0.1mol,含阳离子为0.1mol,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量数数值上近似等于相对原子质量,质子数=原子电子数,氧化还原反应电子转移计算,注意固体硫酸氢钠熔融电离出钠离子和硫酸氢根离子,题目难度中等.
本题难度:简单
5、选择题 某无色溶液中只可能含有Na+ 、Ba2 +、Cl一、Br一、SO32一、SO42一,对该溶液进行下列实验,实验操作和现象如下表:
步骤
| 操?作
| 现?象
|
(1)
| 取少量溶液滴加几滴石蕊试液
| 溶液变蓝
|
(2)
| 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置
| 上层无色,下层呈橙红色
|
(3)
| 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3, 过滤 过滤
| 有白色沉淀产生
|
(4)
| 向(3)的滤液中加入过量AgNO3溶液和稀HNO3
| 有白色沉淀产生
|
下列结论正确的是(?)?
A.可能含有 Cl一、 SO32一、SO42一
B.肯定没有 Ba2 +、Cl一、Br一
C.不能确定 Na+ 、 SO32一、SO42一
D.肯定含有 Na+、Br一、SO32一
参考答案:D
本题解析:略
本题难度:简单