|
高中化学必备知识点《金属的腐蚀与防护》高频试题预测(2017年最新版)(八)
2017-07-18 02:38:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题: 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
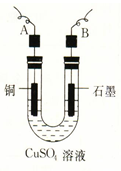
(1)该装置中B电极为电解池的?极(填“阴”或“阳”);
(2)A电极上的电极反应式为?;
电解池总反应的离子方程式为?;
(3)电解过程中,电解质溶液的酸性?(填“增强”、“减弱”或“不变”);
(4)下列实验操作中必要的是?(填写字母);
A.称量电解前的电极的质量;
B.电解后,电极在烘干称量前,必须用蒸馏水冲洗;
C.刮下电解后电极上析出的铜,并清洗,称量;
D.电解后烘干称重的操作中必须按“烘干→称量 →再烘干→再称量”进行; →再烘干→再称量”进行;
| (E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为?(用带有m、V的计算式表示)。
参考答案:
本题解析:略
本题难度:一般
2、填空题 下面是常见的电化学装置图:
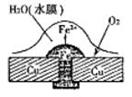 ? ?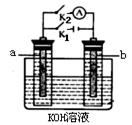 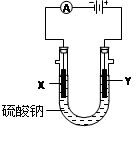
图1?图2?图3
请回答以下问题:(1)图1中铜板上铁铆钉处容易生锈,称为?腐蚀,被腐蚀的金属是?,原电池的总反应方程式是?。
 (2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为?,OH-向?(填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为??,OH-向?(填a或b)极移动。 (2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为?,OH-向?(填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为??,OH-向?(填a或b)极移动。
(3)图3中,X、Y都为石墨电极,在U型管两侧分别加入一滴紫色石蕊试液,则通电后X附近显______色,Y附近显_______色。
参考答案:(1)吸氧? Fe? 2Fe+O2+2H2O=2Fe(OH)2?
(2)? 2H++2e-=H2? a? H2+2OH—+2e-=2H2O? b?(3)蓝?红
本题解析:(1)根据铁所处的环境分析,溶液的酸性很弱,发生吸氧腐蚀。铁比铜活泼,铁失去电子被腐蚀。在正极上溶解在水中的氧气得到电子,发生还原反应。
(2)断开K2,闭合K1则构成电解池,电极均是石墨,电解氢氧化钠溶液,相当于电解水。b与电源的负极相连,作阴极,氢离子放电生成氢气。溶液中的OH-在阳极上放电,产生氧气,所以向a极移动。断开K1,闭合K2,观察到电流计A的指针有偏转,说明此时构成原电池,在b周围有氢气存在,因此作负极。溶液中的阳离子向正极移动,阴离子向负极移动。
(3)石墨电极电解硫酸钠溶液,相当于电解水。Y与电源的正极相连,作阳极,溶液中的OH-放电,产生氧气。X是阴极,溶液中的氢离子放电产生氢气。所以X周围溶液显碱性,Y周围溶液显酸性。
本题难度:一般
3、填空题 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
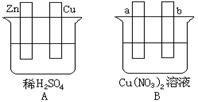
(1)导线将容器A和B连接时,Zn接?,Cu接?(填“a”或“b”)
(2)容器A中Cu极发生的电极反应为?。
(3)B装置叫?,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将?(填“升高”、“降低”或“不变”),加入一定量的?后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:?。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的?
?
?
?。
参考答案:Ⅰ.(1)a,b (2)2H+ + 2e- = H2↑(3)电解池,b(或阳)
(4)降低,CuO?b极材料为Cu
Ⅱ.铁锅是生铁制造的,生铁中的Fe、C和炒菜未洗净的食盐水构成原电池(1分),使铁发生电化学腐蚀生成Fe(OH)2, Fe(OH)2再被氧化成Fe(OH)3,Fe(OH)3部分失水得到铁锈。负极:2Fe - 4e- = 2Fe2+;正极:O2 + 2H2O +4e- = 4OH-;
4Fe(OH) +O2 +2H2O = 4Fe(OH)3
本题解析:I.A可形成原电池,Zn作负极,Cu作正极,使a极析出铜,a极为阴极,所以a与Zn连接,b与Cu连接。A中Cu极发生的反应为2H++2e-=H2↑、Zn极发生的反应为Zn-2e-=Zn2+。B装置叫电解池,溶液中NO3-向阳极移动。电解硝酸铜溶液生成铜、硝酸和氧气,溶液酸性增强,pH减小,阳极析出氧气、阴极析出铜,加入氧化铜能使溶液浓度恢复到反应前浓度,若反应一段时间后Cu2+浓度没有明显下降,说明阳极溶解Cu生成Cu2+。II.铁生锈的机理是铁、炭、食盐水形成原电池,Fe为负极,Fe-2e-=Fe2+。炭为正极,电极反应为O2+2H2O+4e-=4OH-,总反应为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2被氧化为Fe(OH)3、Fe(OH)3失水生成Fe2O3·xH2O。
点评:钢铁电化腐蚀分两种:吸氧腐蚀和析氢腐蚀,当电解质溶液酸性较强时,发生析氢腐蚀;当电解质溶液呈中性或碱性时发生吸氧腐蚀,
本题难度:一般
4、选择题 下列关于金属的腐蚀叙述正确的是
A.金属在潮湿的空气中腐蚀的实质是M+nH2O=M(OH)n+n/2H2↑
B.金属的化学腐蚀实质是M→Mn+ +ne-,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
参考答案:B
本题解析:金属在潮湿的空气中易发生电化学腐蚀,并且一般是吸氧腐蚀,选项A错误;金属的实质是金属失去电子被氧化M→Mn+ +ne-,选项B正确;金属的化学腐蚀是金属直接与具有腐蚀性的的化学物质接触发生氧化还原反应,选项C错误;在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀,选项D错误。
点评:考查金属的腐蚀,难度不大,解题的关键是要掌握金属的腐蚀类型,吸氧腐蚀及析氢腐蚀各自的环境。
本题难度:简单
5、选择题 能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是(? )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠水溶液
D.用铜片作阴、阳电极,电解硫酸铜水溶液
参考答案:C
本题解析:由电极反应式可知,这是一个不能自发进行的氧化还原反应,故只能设计成电解池,由于铜失电子,故铜作电解池的阳极和阴极,电解水。故答案选C
本题难度:一般
|