微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述与电化学腐蚀无关的是( )
A.切过咸菜的菜刀不及时清洗易生锈
B.线路连接时,有经验的电工从不把铝导线和铜导线接在一起
C.银质奖章久置后表面逐渐变暗
D.在轮船的尾部和船壳的水线以下,常装有一定数量的锌块
参考答案:A、铁和碳在盐溶液中形成原电池反应,铁做负极失电子生成亚铁离子,正极上氧气得到电子生成氢氧根离子,氢氧根离子和亚铁离子生成氢氧化亚铁被氧化为氢氧化铁,最后分解生成氧化铁铁锈,原电池反应加快反应速率,能够促进菜刀生锈,属于电化腐蚀,故A不符合;
B、铝和铜遇到电解质溶液会形成原电池反应,铝做负极被腐蚀,是原电池原理的应用,属于电化腐蚀,故B不符合;
C、银质奖章久置后表面逐渐变暗是阴和空气中的氧气反应生成氧化银的原因,和电化腐蚀无关,故符合;
D、锌和铁在海水电解质溶液中形成原电池反应,锌做负极,轮船中铁被保护,属于电化腐蚀,故D不符合;
故选C.
本题解析:
本题难度:一般
2、填空题 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
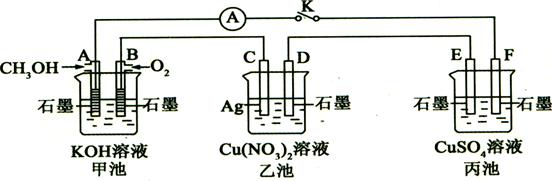
请回答下列问题:
(1)甲池为?(填“原电池”、“电解池”或“电镀池”),
A电极的电极反应式为?。
(2)丙池中F电极为??(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为?。
(3)当乙池中C极质量减轻5.4g时,甲池中B电极理论上消耗O2的体积为??ml(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是?(填选项字母)。
A.Cu
B.CuO
C.Cu(OH)2
D.Cu2(0H)2CO3
参考答案:(1)原电池、? CH4 + 10OH- -8e-= CO32-+ 7H2O?
(2)阴极、? 2CuSO4+ 2H2O ="=" 2H2SO4 + 2Cu + O2↑
(3)280?(4)A
本题解析:有图可以知道,甲为原电池,乙和丙为电解池,(1)中A电极的电极反应式为
CH4 + 10OH- -8e-= CO32-+ 7H2O ,(2)甲电池为原电池,通入甲醇的一极为负极,通入氧气的一极为正极,所以丙池中F电极为阴极,该池的总反应方程式为 2CuSO4+ 2H2O ="=" 2H2SO4 + 2Cu + O2↑;(3)有图可以知道该装置是一个串联电路,串联电路中电流处处相等,乙池中C极质量减轻5.4g时,即转移的电子数为5.4/108=0.05mol,所以B电极理论上消耗O2的体积为为0.05/4*22.4*1000ml=280ml;(4)一段时间后,断开电键K。能使乙池恢复到反应前浓度的是Cu,应该在刚开始点解的时候,有一部分铜在石墨上析出来,之后就就有Ag析出来,所以加入铜可以弥补这部分铜,同时将溶液中的银离子置换出来。
点评:本题考查了原电池、电解池的综合知识,该命题方式是高考命题的热点,本题有一定的综合性,难度较大。
本题难度:一般
3、选择题 下列说法中正确的是( )
A.甲醛含量是检测居室装修材料是否环保的唯一指标
B.Ti-Fe合金是新型储氢合金材料
C.把普通玻璃制成钢化玻璃的过程是化学变化
D.化学腐蚀是造成钢铁腐蚀的主要原因
参考答案:A.居室装修中经常用到的花岗岩、大理石等材料都不同程度地含有放射性元素,如含有铀、钍的花岗石会释放出放射性气体氡,劣质的油性油漆、板材、涂料、胶粘剂等材料含有较多的甲醛、苯、二甲苯等有毒有机物,会造成室内环境污染,故A错误;
B.氢是理想的能源,氢能为清洁、无环境公害的可再生能源,Ti-Fe合金与氢反应后以金属氢化物形式吸氢,生成的金属氢化物加热后释放出氢,可有效地利用这一特性储氢,故B正确;
C.把普通玻璃匀快速加热到接近软化点后再急剧均匀的冷却,改变玻璃的压应力,就得到钢化玻璃,成分与普通玻璃相同,是物理变化,故C错误;
D.日常生活中用的金属为合金,含有不同金属和非金属,在潮湿的环境中易发生吸氧腐蚀,所以钢铁腐蚀以电化学腐蚀为主,电化学腐蚀中以吸氧腐蚀为主,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是( )
A.防止金属发生电化学腐蚀的牺牲阳极保护法运用了原电池原理
B.电解精炼铜时形成的阳极泥,可以用来提取金、银、铂、铁等金属
C.电镀池的阳极材料只能选用镀层金属
D.原电池中电极反应的反应物一定来源于电极材料或电解质溶液
参考答案:A.防止金属发生电化学腐蚀的牺牲阳极保护法中两种活泼性不同的金属和电解质溶液构成了原电池,所以是运用了原电池原理,故A正确;
B.电解精炼铜时,阳极泥中可以回收不如铜活泼的金属,铁以离子形式存在于溶液中而不能回收,故B错误;
C.电镀时,镀层金属作阳极,故C正确;
D.燃料电池中电极反应的反应物不是来源于电极材料或电解质溶液,故D错误;
故选AC.
本题解析:
本题难度:简单
5、选择题 如图甲、乙是电化学实验装置。有关电极反应或计算错误的是:
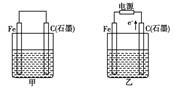
A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH-
B.若乙烧杯中盛有则乙中的总反应为
C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-=Fe2+
D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO
参考答案:D
本题解析:A、若甲烧杯中溶液为氯化钠溶液,类似于钢铁的吸氧腐蚀,石墨棒是正极电极反应式为O2+2H2O+4e-= 4OH-,正确;B、若乙烧杯盛NaCl溶液,据电子的流向可知石墨是阳极,铁做阴极则乙中的总反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,正确;C、此时铁做负极,正确;D、一段时间后溶液的PH为1,此时溶液中H+的物质的量浓度为0.1mol/L,其物质的量为0.2mol,忽略水电离出的氢离子,电解总反应式为2Cu2++2H2O
2OH-+H2↑+Cl2↑,正确;C、此时铁做负极,正确;D、一段时间后溶液的PH为1,此时溶液中H+的物质的量浓度为0.1mol/L,其物质的量为0.2mol,忽略水电离出的氢离子,电解总反应式为2Cu2++2H2O 4H++O2↑+2Cu,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,错误。
4H++O2↑+2Cu,要使溶液恢复原状态,可加入CuO,一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,错误。
本题难度:一般