微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Cl2的说法正确的是(? )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.氯水光照时会放出Cl2,久置后只剩下水
C.实验室制备Cl2时可用排饱和食盐水集气法收集Cl2
D.Cl2能杀菌消毒,不需要进行尾气处理
参考答案:C
本题解析:Cl2和水反应时,Cl2既作氧化剂又作还原剂;氯水中含有HClO,光照时放出O2;Cl2能杀菌消毒,但本身有毒,需要进行尾气处理。
本题难度:简单
2、选择题 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中的HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计)?(?)
A.甲=乙>丙
B.甲>丙>乙
C.丙>甲=乙
D.乙>丙>甲
参考答案:B
本题解析:氯水中存在如下平衡: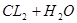 ?
?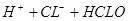 ,若在甲瓶中加入少量的NaHCO3晶体,则使氯水中氢离子浓度减少,平衡向右移动,溶液中HCLO的浓度增大;若在乙瓶中加入少量的NaHSO3晶体,被氯气氧化,使平衡向左移动,溶液中HCLO的浓度减小;所以正确关系为:甲>丙>乙
,若在甲瓶中加入少量的NaHCO3晶体,则使氯水中氢离子浓度减少,平衡向右移动,溶液中HCLO的浓度增大;若在乙瓶中加入少量的NaHSO3晶体,被氯气氧化,使平衡向左移动,溶液中HCLO的浓度减小;所以正确关系为:甲>丙>乙
本题难度:一般
3、选择题 下列有关Cl、N、S等非金属元素化合物的说法正确的是:(?)
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥HI气体
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Cl2与SO2以等物质的量比同时通入品红溶液,能增强其漂白性。
参考答案:C
本题解析:白粉的成分为次氯酸钙和氯化钙,有效成分是次氯酸钙,A不正确。碘化氢具有还原性,能被浓硫酸氧化,B不正确。氯气具有氧化性,SO2具有还原性,二者发生氧化还原反应,生成盐酸和硫酸,漂白性降低。所以选项C是正确的,答案选C。
本题难度:一般
4、选择题 氯气可用于消毒,是因为氯气(?)
A.具有强氧化性
B.能与水反应生成次氯酸
C.有毒
D.容易液化
参考答案:B
本题解析:氯气溶于水生成的次氯酸具有漂泊性,能杀菌消毒,而并不是氯气直接杀菌消毒,答案选B。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识对巩固和训练,难度不大,记住即可。
本题难度:简单
5、填空题 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
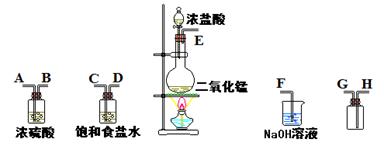
(1)连接上述仪器的正确顺序(填各接口处的字母):?接?;?接?;
?接?;?接?。
(2)装置中,饱和食盐水的作用是?;NaOH溶液的作用是?。
(3)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到?,反应方程式?。
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:?
②NaOH溶液中发生的反应:?
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为?;
③当有0.2mole-转移时被氧化的HCl的质量是?;该反应中被氧化和未被氧化的盐酸的物质的量之比是?,
④如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将?。
A.≥1.68L
B.>1.68L
C.≤1.68L
D.<1.68L
参考答案:(1)E接C;D接A;B接H;G接F。
(2)除去氯气中的HCl杂质;吸收过量的氯气。
(3)试纸变蓝? 2KI+Cl2===2KCl+I2
(4)①MnO2+4HCl(浓) MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
②2NaOH+Cl2=NaCl+NaClO+H2O
(5)① ②1:5③7.3克? 5:3,
②1:5③7.3克? 5:3,
④D
本题解析:二氧化锰和浓盐酸共热产生氯气,将气体依次通过饱和食盐水和浓硫酸,分别除去HCl和H2O,然后用向上排空气法收集氯气,最后用氢氧化钠溶液吸收尾气。可用湿润的淀粉-KI试纸检验氯气是否收集满,Cl2+2KI=I2+2KCl,现象为试纸变蓝。高锰酸钾与浓盐酸反应中,高锰酸钾是氧化剂,盐酸是还原剂,16molHCl反应被氧化的HCl被10mol,氧化剂、还原剂物质的量比为2:10。每1molHCl被氧化转移电子1mol,反应中被氧化和未被氧化的HCl物质的量比为10:6。随着反应进行,盐酸由浓变稀,所以生成Cl2物质的量小于0.075mol。
点评:二氧化锰与浓盐酸反应,随着反应进行,盐酸由浓变稀,稀盐酸与二氧化锰不产生氯气。
本题难度:一般